Хронический миелолейкоз
Хронический миелолейкоз — это злокачественное заболевание крови, при котором происходит избыточное образование и нарушение созревания гранулоцитов в костном мозге. Уникальной особенностью данного вида лейкоза является наличие в опухолевых клеток специфического маркера — филадельфийской хромосомы. Она образуется в результате транслокации t(9;22), при которой один фрагмент 22 хромосомы меняется местами с фрагментом девятой хромосомы. В итоге образуется химерный ген, который нарушает процесс деления и созревания клеток миелоидного ряда.
Причины развития хронического миелолейкоза
Причиной развития хронического миелолейкоза является та самая мутация, которая приводит к образованию филадельфийской хромосомы. Ее обнаруживают у 90-95% больных. Но вот что становится причиной ее образования до сих пор неизвестно.
Из эпидемиологических данных известно, что заболевание чаще развивается у пожилых людей, преимущественно мужчин. Дети страдают крайне редко, на их долю приходится около 2% всех случаев хронического миелолейкоза.
Патогенез хронического миелолейкоза
Филадельфийская хромосома является результатом взаимной транслокации между 9 и 22 хромосомами. При этом онкоген ABL из 9 хромосомы переносится на 22 хромосому и присоединяется к гену BCR. В результате образуется гибридный BCR-ABL ген, который регулирует синтез особого онкогенного белка — тирозинкиназы bcr-abl. Этот онкопротеин нарушает процесс клеточного деления, защищает опухолевые клетки от запрограммированной гибели (апоптоза) и нарушает их сцепление со стромой костного мозга, благодаря чему недозревшие клетки выходят в кровяное русло.
Чаще всего хронический миелолейкоз развивается в результате мутации в плюрипотентной гемопоэтической стволовой клетке, которая располагается в костном мозге, но есть случаи, когда первичный очаг находится в печени или селезенке.
При хроническом миелолейкозе в основном преобладает патология гранулоцитарного ростка, но могут страдать все линии гемопоэза — эритроцитарный росток, моноциты и др. Здоровые стволовые клетки сохраняются и могут давать начало новому кроветворению после проведения химиотерапии.
Стадии хронического миелолейкоза
В течении хронического миелолейкоза выделяют 4 стадии, которые отражают прогрессирование патологии. При этом заболевание может быть выявлено на любой из них.
Хроническая или доклиническая стадия — не имеет клинических симптомов, диагноз можно заподозрить по общему анализу крови, который пациенты могут сдавать либо в рамках диспансеризации, либо по поводу диагностики другого заболевания. В большинстве случаев хронический миелолейкоз выявляется именно на этой стадии.
Фаза акселерации, или стадия прогрессирования. В этот период нарастает количество опухолевых гранулоцитарных клеток, появляются различные симптомы, например, слабость или боли в костях. Объективно отмечается увеличение количества бластов в крови или костном мозге до 15-29%, увеличивается количество базофилов (более 20%), обнаруживается тромбоцитопения или тромбоцитоз (более 1000×10 9 ).
Бластный криз — это фаза, во время которой происходит резкое увеличение количества бластных клеток (больше 30%) и болезнь по своему течению напоминает агрессивный острый лейкоз.
Пациент при этом находится в тяжелом состоянии. Отмечается повышение температуры, упорные инфекции, кровотечения, лейкозные поражения кожи. На этой стадии лейкоз с трудом поддается терапии.
Фазу хронического миелолейкоза обязательно оценивают при постановке диагноза и далее перепроверяют при прогрессировании патологии и необходимости смены лечения.
Симптомы и признаки хронического миелолейкоза
Симптоматика хронического миелолейкоза характеризуется многообразием клинических проявлений и зависит от агрессивности течения и стадии заболевания. В целом может иметься несколько синдромов:
- Синдром опухолевой интоксикации. Проявляется неадекватной текущему состоянию слабостью, потерей веса, снижением аппетита. Может быть повышение температуры, повышенная потливость, зуд кожи, боли в костях.
- Синдром опухолевой пролиферации. Развивается при активном увеличении количества злокачественных клеток, инфильтрирующих печень и селезенку. При этом пациенты отмечают боль и тяжесть в левом боку.
- Анемический синдром — развивается при снижении количества эритроцитов и уровня гемоглобина. Проявляется слабостью, одышкой, повышенной утомляемостью при рутинных физических нагрузках. Может наблюдаться снижение давления, бледность кожи и слизистых, головокружение, тахикардия.
- Нарушения со стороны кровесвертывающей системы — тромбозы и геморрагии (кровотечения). Причиной тромбозов чаще всего оказывается тромбоцитоз (повышение уровня тромбоцитов выше 1000×10 9 /л). При этом могут возникать тромбофлебиты, инфаркты, инсульты. Геморрагические проявления характеризуются увеличением времени кровотечения после травмы, а также образованием петехиальной геморрагической сыпи. Развиваются они на фоне критического снижения уровня тромбоцитов.
Диагностика хронического миелолейкоза
В большинстве случаев хронический миелолейкоз является случайной находкой, которая обнаруживается при обследовании по другому поводу. Заподозрить его можно по общему анализу крови, в частности по увеличению количества лейкоцитов и преобладанию в формуле гранулоцитарного ростка кроветворения. При этом может увеличиваться не только количество нейтрофилов, но и базофилов с эозинофилами. Может быть умеренная анемия или отклонения в количестве тромбоцитов.
Если врач подозревает хронический миелолейкоз, пациента направляют на дальнейшее обследование — пункцию и биопсию костного мозга. Для подтверждения диагноза необходимо проводить стандартное цитогенетическое исследование костного мозга на предмет наличия филадельфийской хромосомы. Исследуется не менее 20 метафаз. При невозможности проведения цитогенетики, прибегают к флюоресцентной in situ гибридизации, с помощью которой выявляют химерный ген. Также определяется экспрессия химерного гена в клетках периферической крови посредством ПЦР. Если типичный транскрипт не обнаруживается, а при этом есть клинико-гематологические признаки хронического миелолейкоза, показано определение более редких мутаций — BCR-ABLp190, р230.

В фазе бластного криза проводят иммунофенотипирование бластных клеток, цитологическое и биохимическое исследование спинномозговой жидкости. При обнаружении хронического миелолейкоза в фазе активации или бластного криза, поиск филадельфийской хромосомы может осуществляться посредством секвенирования генетического материала клеток крови.
Лечение хронического миелолейкоза
На начальном этапе, до получения цитогенетического подтверждения диагноза (как мы уже знаем, хронический миелолейкоз выставляется при наличии филадельфийской хромосомы), назначается симптоматическая терапия гидроксимочевиной. Ее целью является снижение общего уровня лейкоцитов и тромбоцитов. При непереносимости препарата или недостаточном снижении уровня тромбоцитов может применяться анагрелид. Если имеются признаки лейкостаза (энцефалопатия, зрительные нарушения, нарушения работы почек), проводится лейкаферез.
После цитогенетического подтверждения диагноза, назначается специфическая противоопухолевая терапия. Главными препаратами являются ингибиторы тирозинкиназ (ИТК). Дозировка подбирается в зависимости от уровня лейкоцитов. На начальном этапе для профилактики синдрома лизиса опухоли необходима усиленная гидратация (дополнительное введение жидкости в объеме 2-2,5 л/м 2 , если нет противопоказаний со стороны сердечно-сосудистой системы) и назначение аллопуринола.
Целью специфического лечения хронического миелолейкоза является подавление опухолевого клона клеток, снижение риска прогрессирования патологии и продление жизни пациента до значений, сопоставимых с общепопуляционными показателями. С внедрением в практику ИТК эти задачи стали вполне выполнимы и не только позволили повысить общую выживаемость таких больных в несколько раз, но и оказаться от пожизненного приема препаратов и перехода под динамическое наблюдение у пациентов с хорошим молекулярным ответом опухоли.
В настоящее время согласно принятым протоколам лечения, ИТК должны назначаться всем больным с впервые выявленным хроническим миелолейкозом. В основе механизма их действия лежит блокада АТФ-связывающего кармана патологической молекулы BCR-ABL, что лишает этот белок тирозинкиназной активности, которая стимулирует избыточное деление опухолевых клеток. При постоянном приеме ИТК, опухолевый клон подвергается редукции, что дает возможность восстановлению нормального кроветворения.
В России для терапии первой линии зарегистрированы следующие препараты из группы ИТК:
- иматиниб,
- нилотиниб,
- дазатиниб.
Иматиниб
Иматиниб обладает избирательной активностью в отношении BCR-ABL тирозинкиназы и некоторых других тирозинкиназ. Назначается длительными курсами и должен приниматься ежедневно. Первоначальная дозировка составляет 400 мг в сутки при хронической фазе миелолейкоза, и 600 мг/сут при фазе акселерации или бластном кризе. Дозировка не зависит от роста, пола и массы тела пациента. Препарат выпускается в таблетированной форме или капсулах. Может применяться в амбулаторных условиях. При неудовлетворительном результате терапии, дозировка может быть увеличена, при развитии токсических осложнений — снижена.
Нилотиниб
Нилотиниб — высокоселективный ингибитор BCR-ABL тирозинкиназы. Был разработан на основе молекулы иматиниба и модифицирван для увеличения сродства к BCR-ABL тирозинкиназой. Выпускается в капсулах. Дозировка при терапии хронической фазы составляет 600 мг/сут, при терапии фазы акселерации — 800 мг/сут. Препарат принимают 2 раза в сутки с интервалом в 12 часов строго натощак, поскольку еда увеличивает биодоступность препарата, что повышает его концентрацию в плазме и может спровоцировать развитие токсических осложнений. При недостаточном терапевтическом эффекте в лечении хронической фазы, возможно увеличение дозировки до 800 мг/сутки. При развитии осложнений, дозу снижают.
Дазатиниб
Дазатиниб обладает активностью ко многим тирозинкиназам, в том числе и к мутантной BCR-ABL. Проникает через гематоэнцефалический барьер. Выпускается в формах для перорального применения. Рекомендуемая дозировка составляет 100 мг/сутки для хронической фазы и 140 мг/сут для фазы акселерации и бластного криза. При недостаточной эффективности терапии хронической фазы возможно увеличение дозировки до 140 мг/сут. При развитии токсических осложнений ее снижают до 80 мг/сутки.

Босутиниб
Босутиниб — относительно новый препарат, в России зарегистрирован в 2014 году и применяется для терапии второй и последующих линий при непереносимости или неэффективности вышеперечисленных препаратов. Стандартная суточная доза составляет 500 мг, при необходимости может быть увеличена до 600 мг.
Выбор препарата первой линии проводится индивидуально для каждого пациента. При этом учитывается фаза лейкоза, чувствительность опухолевого клона с отдельными мутациями, профиль токсичности каждого препарата и наличие у пациента сопутствующих заболеваний.
Определение спектра мутаций проводится при манифестации патологии с фазу акселерации или бластного криза, либо при неэффективности терапии выбранным препаратом и необходимости смены препарата, поскольку здесь есть вероятность возникновения резистентных клонов. Например, мутации F317L/V, T315A, V299L обуславливают низкую чувствительность к дазатинибу, поэтому его меняют на нилотиниб. Мутации Y253H, E255K/V, F359V/C, наоборот, делают опухолевые клетки резистентными к нилотинибу, поэтому таким пациентам показан дазатиниб.
Мутации E255K/V, G250E, V299L обуславливают устойчивость к босутинибу. Наличие мутации Т3151 определяет устойчивость ко всем видам ИТК, поэтому таким пациентам рекомендуется аллогенная трансплантация гемопоэтических стволовых клеток. Также возможен вариант терапии понатинибом, но он пока не зарегистрирован в России.
Эффект терапии первой линии может быть отнесен к одной из трех групп:
- Оптимальный ответ. Это хороший результат, который позволяет надеяться на длительный период безрецидивной выживаемости (7-8 и более лет). Критерием достижения оптимального ответа является полный гематологический ответ в течение 3 месяцев, полный цитогенетический ответ в течение 6 месяцев и большой молекулярный ответ в течение 12-18 месяцев.
- Предупреждение. При наличии предупредительных факторов требуется тщательный мониторинг состояния больного и готовность к смене режима лечения. Факторами предупреждения является группа высокого риска хронического миелолейкоза, увеличение более, чем в 10 раз уровня транскрипции мутантного гена, наличие дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой.
- Неудача терапии. Сюда относят прогрессирование заболевания, возникновение новыхмутаций, появление дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой. Требуется смена терапии.
Другие методы лечения хронического миелолейкоза
Трансплантация донорских стволовых клеток показана пациентам с неэффективностью терапии второй линии и пациентам с мутацией T315I. Пациентам с непереносимостью ИТК и невозможностью проведения трансплантации возможно лечение с помощью гидроксимочевины, интерферонов и цитостатиков.
Прогноз и профилактика хронического миелолейкоза
Специфических методов профилактики не существует, поскольку неизвестны причины, из-за которых образуются мутации, вызывающие хронический миелолейкоз. Что касается прогноза, то здесь все зависит от возраста больного, ответа на лечение и возможности проведения аллогенной трансплантации. В целом ситуация довольно благоприятная и позволяет надеяться на продолжительность жизни, сопоставимую с общепопуляционными показателями. У некоторых больных возможно достижение стойкой ремиссии и отказ от пожизненного приема ИТК с регулярным динамическим наблюдением.
В клинике «Евроонко» лечение миелолейкоза соответствует всем современным лечебным протоколам. В сложных случаях, решение принимает консилиум специалистов, а при достижении ремиссии, мы особое внимание уделяем регулярному наблюдению пациента, что также позволяет улучшать результаты лечения.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – еще одна разновидность рака крови, характеризующаяся нарушением нормального кроветворения. Это онкологическое заболевание сопровождается производством избыточного количества аномально незрелых клеток крови – предшественников лейкоцитов. Патологически измененные клетки крови накапливаются в костном мозге и распространяются по организму, вызывая необратимые процессы: от формирования онкологических опухолей до летального исхода.
Острый миелоидный лейкоз – что это?
Острый миелоидный лейкоз является наиболее распространенным видом лейкоза у взрослых. Он развивается в костном мозге, подавляя рост нормальных клеток крови и заменяя их на миелобласты– незрелые белые кровяные клетки. Результатом этого процесса становится снижение количества тромбоцитов, красных кровяных клеток и нормальных лейкоцитов. Как и все острые заболевания, миелоидный лейкоз развивается молниеносно. Без своевременного и правильного лечения острый миелоидный лейкоз может закончиться летальным исходом спустя всего несколько недель после возникновения. Поэтому очень важно, как можно раньше начинать лечение острого миелоидного лейкоза, тем более что он может распространиться в другие органы и ткани: в селезенку, печень, головной мозг и т.д.
Ожидаемый результат лечения острой миелоидной лейкемии зависит от определенных факторов, в некоторых случаях влияющих на успешное выздоровление. Вы имеете больше шансов поправиться, если:
- ваш возраст еще не преодолел отметку в 60 лет;
- у вас не было ранее онкологических заболеваний;
- в вашем организме не наблюдаются генетически обусловленные аномалии – мутации.
2. Факторы риска заболевания
Факторы риска острого миелоидного лейкоза представляют собой обстоятельства, наличие которых предполагает развитие этого онкологического заболевания. Выявление предрасположенности вовсе не означает, что вы рано или поздно услышите страшный диагноз, так как точные причины, провоцирующие появление лейкоза до сих пор не установлены.
К наиболее распространенным факторам, воздействие которых на организм человека влияет на возникновение онкологии, можно отнести:
- курение;
- воздействие химических веществ: моющих и чистящих средств, растворителей;
- воздействие высоких доз радиации;
- использование сильных химиотерапевтических препаратов;
- заболевания крови;
- врожденные синдромы.
Несмотря на то, что причина острого миелоидного лейкоза до сих пор остается неизвестной, вы можете предпринять профилактические меры для того, чтобы обезопасить себя от него. Например, откажитесь от курения и сведите к минимуму контакт с ядовитыми химическими веществами.
3. Симптомы острой миелоидной лейкемии
Недостаточность костного мозга, возникающая вследствие угнетения нормального кроветворения бластной пролиферацией – деления пораженных клеток, характеризуется следующей симптоматикой.
- Анемическим синдромом – состоянием, обусловленного уменьшением содержания гемоглобина и количества эритроцитов в крови. Для него характерны такие признаки, как слабость, отдышка, сонливость и бледность;
- Кровоточивостью слизистых оболочек и кожной геморрагией. Отличительной особенностью лейкозов является возникновение самопроизвольных кровотечений, которые очень сложно остановить;
- Склонностью к инфекционным заболеваниям различной природы. Онкология ослабляет иммунную систему человека, вследствие чего увеличивается его подверженность вирусным, грибковым и бактериальным инфекциям;
- Нарушением свертываемости крови. Данное состояние характеризуется снижением массы тела больного, лихорадкой, ухудшением аппетита, усиленной потливостью, болезненностью костей, увеличением размеров селезенки и печени, кровоточивостью десен и т.д;
Если вы наблюдаете хотя бы один из перечисленных симптомов и отмечаете беспричинное ухудшение самочувствия – обязательно расскажите о своем недомогании врачу. Медицинский специалист поможем вам разобраться в ситуации и выяснить, в чем кроется причина вашей слабости.
4. Как вылечить лейкемию?
Острый миелоидный лейкоз – это совокупность онкологических заболеваний, поэтому лечение этого заболевания зависит в первую очередь от того, в каком органе произошло скопление патологически измененных клеток, а также от множества других факторов. Огромное значение в онкологии имеет своевременное лечение, поэтому его следует начинать сразу после установления диагноза.
В большинстве случаев лечение острого миелоидного лейкоза представляет собой совокупность методов, включающих в себя лучевую и химическую терапию, а также трансплантацию костного мозга.
Химиотерапия основывается на использовании противоопухолевых препаратов: Преднизона, Цитарабина и других медикаментов. Как правило, этот метод лежит в основе лечения онкологических заболеваний. Лучевая терапия осуществляется с использованием высокоэнергетического излучения, которое убивает раковые клетки. Особенностью этого метода является то, что воздействию подвергаются только патологически измененные клетки. Трансплантация костного мозга заключается в пересадке стволовых клеток костного формирования от подходящего донора.
Рассмотрим более внимательно лечение острого миелоидного лейкоза. Оно условно подразделяется на несколько этапов: индукцию ремиссии и консолидации. Цель индукционной терапии заключается в достижении ремиссии, уничтожив максимальное количество вредоносных клеток. Терапия консолидации представляет собой терапию закрепления ремиссии. Она необходима для уничтожения остаточного количества аномальных бластных клеток во избежание рецидива – повторного возникновения заболевания.
Каковы показатели выживаемости при острой миелоидной лейкемии? За последние пять лет этот показатель увеличился на 24%. Подобный положительный прогноз свидетельствует о том, что это смертельное заболевание можно победить! Самое главное вовремя начать лечение острого миелоидного лейкоза и регулярно обследоваться для предотвращения повторного возникновения патологически измененных клеток.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.

Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
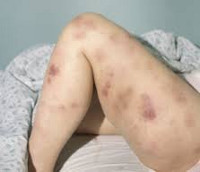
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – это поражение костного мозга, из-за которого измененные белые кровяные клетки размножаются слишком быстро.
Заболевание, которое обыватели называют «раком крови», может возникнуть у людей любого пола и возраста, но чаще всего встречается у мужчин от 65 лет и старше.
Как развивается острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) начинается в костном мозге – мягкой внутренней части костей, состоящей из жировых и кроветворных клеток, включая стволовые, которые становятся:
- лимфоцитами, основной задачей которых является борьба с инфекциями и повреждением тканей;
- либо миелоидными клетками, способными превращаться в: белые и красные кровяные тельца, переносящие кислород из легких в другие ткани, а также тромбоциты, необходимые для остановки кровотечений – они помогают закрывать отверстия в сосудах, возникающие при порезах или ушибах.
Лейкоз начинается с изменения ДНК – содержащейся в каждой клетке нашего тела молекулы, в которой зашифрована вся информация об организме. Такие «поломки» возникают из-за воздействия химикатов, радиации, различных заболеваний или случайных сбоев, и приводят к производству слишком большого количества бластов – быстро растущих незрелых, то есть не работающих белых кровяных телец.
Нормальные бласты со временем превращаются в полезные клетки крови, а при лейкозе они становятся опухолевыми, активно размножаются и постепенно вытесняют нормальные, что приводит к ряду тяжелых последствий. У здорового человека их не много – они составляют 5% или меньше от костного мозга, а в крови не обнаруживаются. Для того, чтобы врач поставил диагноз «острый миелоидный лейкоз», их должно быть не менее 20%.
Такие клетки не просто циркулируют по организму – они распространяются в различные органы, включая лимфатические узлы, печень, селезенку, яички, головной и спинной мозг, скапливаются и повреждают их.
Врачи выделяют две основных формы миелоидного лейкоза:
– острый – развивающийся внезапно и быстро;
– и хронический – при данном типе заболевания бласты вытесняют здоровые клетки крови гораздо медленнее, чем при остром.
Причины возникновения острого миелоидного лейкоза
Точные причины развития данного заболевания врачам до сих пор не известны – они знают лишь о факторах, которые могут спровоцировать его возникновение:
- Возраст: острый миелоидный лейкоз возникает и у детей, и у взрослых, но чаще всего он обнаруживается у пожилых людей, а средний возраст постановки диагноза составляет около 68 лет.
- Курение – единственный доказанный фактор риска, связанный с образом жизни. Вредная привычка способна вызвать не только рак легких, рта или горла, поскольку ядовитый дым влияет и на клетки, которые не вступают с ним в прямой контакт. Содержащиеся в нем вещества поглощаются дыхательными путями и с кровью распространяются в различные части тела, в том числе в костный мозг.
- Химикаты: с развитием лейкоза связывают длительное воздействие бензола – растворителя, который используется в резиновой и автомобильной промышленности, а также на нефтеперерабатывающих заводах. Он содержится в бензине, сигаретном дыме, выхлопных газах машин, некоторых клеях, чистящих средствах и красках.
- Радиация: ее воздействие, в том числе полученное при лучевой терапии рака, увеличивает вероятность возникновения ОМЛ.
- Заболевания крови также относят к факторам риска, способным спровоцировать острый миелоидный лейкоз.
- Пол: взрослым мужчинам данный диагноз ставится чаще, чем женщинам, при этом среди юных пациентов мальчиков примерно столько же, сколько девочек. Причины такой статистики ученым до сих пор не известны.
- Генетические нарушения. Шанс образования ОМЛ повышен у обладателей различных генетических нарушений и особенностей, включая синдром Дауна Синдром Дауна – это генетическое нарушение, вызывающее умственную отсталость, задержку развития, пороки сердца и множество других проблем со здоровьем. У людей с данной особенностью развития есть не 46 хромосом, а на одну больше – 47. и трисомию 8 Трисомия 8 – это генетическое нарушение развития, у обладателей которого есть не две копии восьмой хромосомы, а целых три. .
- Лечение: заболевание чаще развивается у онкологических пациентов, которые получают определенные химиотерапевтические препараты. К ним относятся циклофосфамид, мехлорэтамин, прокарбазин, хлорамбуцил, мелфалан, бусульфан, кармустин, цисплатин, карбоплатин, этопозид, тенипозид, митоксантрон, эпирубицин и доксорубицин.
- Семейный анамнез: наличие близкого родственника – родителя, брата, сестры или детей – с данным диагнозом увеличивает риск развития данного заболевания.
Симптомы острого миелоидного лейкоза
Признаки лейкоза проявляются примерно одинаково как у детей, так и у взрослых, и могут выглядеть следующим образом:
- Обычно одними из первых симптомов становятся чрезмерная утомляемость и слабость. Они возникают из-за анемии – снижения количества красных кровяных телец, переносящих кислород ко всем тканям организма.
- Головокружения – еще один частый спутник заболевания. Самая вероятная причина их появления – все та же анемия, из-за которой мозгу не хватает О2.
- Внезапное снижение веса: как правило, люди худеют уже на ранних стадиях заболевания, в том числе из-за уменьшившегося аппетита.
- Синяки или кровоизлияния: по мере развития острого миелоидного лейкоза костный мозг производит все меньше тромбоцитов – клеток, отвечающих за свертывание крови. Когда их становится слишком мало, у человека легко появляются синяки и красные или фиолетовые пятна на коже, кровь идет из носа и десен, ее следы обнаруживаются в моче или стуле, а менструации становятся более обильными.
- Повышенная температура в любое время суток и ночная потливость: часто бывают вызваны в том числе инфекциями, развивающимися при нарушении работы кроветворной системы.
- Бледная или холодная кожа, а также чувствительность к низким температурам, вызванные анемией.
- Кровоточивость, боль и отеки десен: может быть признаком тромбоцитопении – нехватки необходимых для правильной свертываемости крови тромбоцитов.
- Одышка – ощущение нехватки воздуха: на ранних этапах лейкоза она обычно спровоцирована нехваткой переносящих кислород клеток, а на поздних может быть вызвана тромбоэмболией – закупоркой легочной артерии. Это серьезное осложнение вызывает целый комплекс симптомов, таких как боль в груди, шее, плечах, руках и челюсти, тревожность и беспокойство, аритмия – неправильный ритм сердцебиения, тахикардия – слишком частое сокращение сердца, и обмороки.
- Частые инфекции – еще один признак заболевания, который появляется из-за присутствия в организме большого количества измененных белых кровяных телец. Их избыток приводит к нехватке нормальных нейтрофилов – клеток, которые борются с бактериями и грибками.
- Лейкостаз: скопление измененных клеток в сосудах, что приводит к появлению похожих на инсульт Инсульт – это нарушение кровообращения в головном мозге. симптомов: сонливости, головным болям, онемению лица, нехватке воздуха, нарушениям зрения, слабости и даже проблемам с речью.
- Вздутие живота: не самая распространенная проблема у обладателей острого миелоидного лейкоза. Она возникает при накоплении неправильных клеток в селезенке и печени, что приводит к нарушению пищеварения.
- Сыпь или уплотнения: наблюдаются примерно у 10% пациентов. Их наличие может говорить о распространении болезни на кожу.
- Еще один возможный симптом – боль в суставах и костях из-за присутствия в них большого количества измененных клеток.
- Головные боли – могут быть признаком как анемии, так и повреждения мозга.
- Увеличение лимфатических узлов – наших крошечных «фильтров», задерживающих и обезвреживающих опасные вещества. Часто они ощущаются как небольшие образования размером с горошину – под кожей в области шеи, подмышек или паха.
Диагностика острого миелоидного лейкоза
Тщательная диагностика крайне важна, поскольку в ее ходе доктор может не только установить сам факт наличия заболевания, но и понять, какое именно лечение подходит конкретному пациенту.
Диагностика начинается с обычного медицинского осмотра и поисков синяков, кровоподтеков или возможных признаков инфекции, после чего назначается целый ряд процедур:
- Анализы крови: позволяют видеть ее состав, обнаруживать измененные клетки, а также оценивать работу внутренних органов, таких как печень или почки.
- Сбор образцов костного мозга: процедура обязательная, поскольку именно в нем начинает развиваться заболевание. Как правило, пробы забирают из задней части тазовой или грудной костей в ходе двух болезненных, одновременно проводимых процедур. При аспирации пациент ложится на бок или живот, врач очищает кожу бедра, обезболивает ткани и вводит в них тонкую иглу, после чего шприцем отсасывает небольшое количество жидкого костного мозга. При биопсии специалист с помощью более толстой иглы удаляет еще и небольшие кусочки кости.
- Анализ спинномозговой жидкости – люмбальная, или спинномозговая пункция: назначается, если у человека есть симптомы, которые могут быть вызваны распространением измененных клеток в головной или спинной мозг. При сборе образцов доктор обезболивает участок кожи в нижней части спины над позвоночником, и вводит небольшую иглу в область между позвонками.
- Молекулярные и генетические тесты: необходимы для обнаружения мутаций, или изменений, в генах. Такие данные необходимы врачам для подбора оптимального лечения.
- Визуальные исследования – УЗИ, рентген, КТ, МРТ или ПЭТ: создают изображения внутренних тканей тела. Их назначают не для выявления лейкоза как такового, а для обнаружения инфекций, других проблем со здоровьем или определения запущенности заболевания, если специалисты считают, что оно распространилось за пределы костного мозга.
Лечение острого миелоидного лейкоза
Борьба с лейкозом – задача сложная и требует участия сразу нескольких врачей – не только гематолога, но и онколога, химиотерапевта и других.
В Онкоцентре «Лапино-2» есть целая команда отличных специалистов, которые не просто быстро выявят заболевание, но и проведут любые необходимые лечебные процедуры.
Вам не придется задаваться вопросом «что делать?» и «к кому обращаться?» – у нас вы получите четкий план действий, следуя которому пройдете терапию без очередей, задержек и нервов.

При лечении миелоидного лейкоза врачи применяют несколько методов.
-
Химиотерапия – уничтожение измененных клеток специальными препаратами. Такие вещества вводятся с помощью капельниц или принимаются в виде таблеток, попадают в кровь и распространяются по всему организму.
- Индукция ремиссии: первая фаза, задача которой заключается в быстром сокращении как можно большего количества лейкозных клеток. Во время ее проведения человек обычно находится в лечебном учреждении, поскольку лекарства разрушают не только неправильные, но и нормальные клетки костного мозга. В результате такого воздействия на организм показатели крови становятся опасно низкими, из-за чего самочувствие больного ухудшается. Многим людям приходится принимать антибиотики и препараты, повышающие количество белых кровяных телец, а некоторым требуется переливание крови. Примерно через неделю после окончания химиотерапии врач проводит биопсию и изучает состояние изъятых тканей. У большинства пациентов после первого же курса наступает ремиссия – бласты Бласты – это быстро растущие незрелые, не работающие белые кровяные тельца. составляют не более 5% от общего объема костного мозга. Если анализы выявляют их избыток, человеку назначают повторное лечение, либо рекомендуют пересадку стволовых клеток Стволовые клетки, производимые костным мозгом, могут становиться: красными кровяными тельцами, переносящими кислород по телу; лейкоцитами, помогающими бороться с инфекциями; и тромбоцитами, которые останавливают кровотечения.) . Во время этапа индукции все бласты обычно убить не получается – небольшая их часть все же остается в организме. В таком случае терапию нужно продолжить, поскольку иначе заболевание может вернуться в течение нескольких месяцев.
- Консолидация – вторая фаза, назначаемая для полного уничтожения измененных клеток и предотвращения рецидива – повторного развития лейкоза. Ее схема подбирается индивидуально для каждого пациента – она зависит не только от общего состояния здоровья человека, но и от его возраста.
- аллогенную трансплантацию клеток подходящего донора – близкого родственника, такого как брат или сестра, или другого добровольца;
- или пересадку аутологичных – собственных стволовых клеток человека, изъятых и замороженных еще до начала курса «химии».
- одни блокируют белки, которые помогают неправильным клеткам расти;
- вторые помогают им превращаться в нормальные;
- третьи убивают их при попытке разделения для создания новых;
- четвертые нацелены на белки, помогающие им жить слишком долго;
- пятые снижают выживаемость и уменьшают рост лейкозных клеток.
- при распространении заболевания за пределы костного мозга и крови: например, в мозг, спинномозговую жидкость или яички;
- перед трансплантацией стволовых клеток Стволовые клетки, производимые костным мозгом, могут становиться: красными кровяными тельцами, переносящими кислород по телу; лейкоцитами, помогающими бороться с инфекциями; и тромбоцитами, которые останавливают кровотечения.) ;
- для сокращения опухолей, которые давят на трахею – дыхательное горло, и не позволяют человеку получать достаточное количество кислорода;
- для уменьшения боли в области пораженной кости, если этого не удалось добиться с помощью химиотерапии.
Статус острого миелоидного лейкоза после лечения
Долгосрочные прогнозы каждого пациента в немалой степени зависят от того, насколько хорошо и быстро заболевание поддается лечению: чем лучше первая реакция организма, тем оптимистичнее перспективы.
Ремиссия – отсутствие признаков лейкоза: в костном мозге содержится меньше 5% бластов Бласты – это быстро растущие незрелые, не работающие белые кровяные тельца. , а количество клеток крови находится в пределах нормы. Полная молекулярная ремиссия означает, что врачам не удалось обнаружить измененные клетки даже с помощью очень чувствительных тестов.
Минимальная остаточная болезнь , МОБ: данный термин используется в тех случаях, когда после проведения терапии неправильные клетки не обнаруживаются обычными методами – например, при стандартном осмотре образцов под микроскопом, но выявляются при проведении современных точных исследований.
Активное заболевание: после лечения в костном мозге есть больше 5% бластов, либо после проведенной терапии произошел рецидив – возвращение болезни.

Прогнозы и выживаемость при остром миелоидном лейкозе
Перспективы каждого человека индивидуальны и зависят от большого количества факторов.
Немаловажную роль играет возраст – например, люди старше 60 обычно уже имеют хронические проблемы со здоровьем, которые усугубляют ситуацию. Кроме того, их организм тяжело переносит сильнодействующие химиотерапевтические препараты и другие виды лечения. По данным исследований , только 40% пациентов в возрасте от 65 лет способны получать подобные вещества на протяжении 3 месяцев.
Для каждого вида заболевания есть своя статистика.
После индукции – первого же курса химиотерапии выходят в ремиссию, то есть нормализуют количество клеток крови, около 90% обладателей острого промиелоцитарного лейкоза. Для всех остальных типов эта цифра составляет примерно 67%.
Кроме того, многие люди 60+ не реагируют на лечение, и всего лишь у половины из них после индукции наступает ремиссия.
Пятилетняя выживаемость – вероятность прожить 5 или больше лет с даты постановки диагноза, для взрослых составляет около 27,4% . Это означает, что спустя 5 лет с момента обнаружения заболевания в живых остается 27,4% пациентов.
У детей статистика своя: от 85% до 90% из них выходят в ремиссию после индукции, а их пятилетняя выживаемость составляет от 60% до 70%.
Острый миелобластный лейкоз

Острым миелобластным лейкозом (наиболее часто используемая аббревиатура — ОМЛ) называют злокачественную патологию крови и костного мозга, характеризующуюся бесконтрольным продуцированием незрелых (бластных) миелоцитарных клеток — эритроцитов, гранулоцитов, нейтрофильных лейкоцитов, тромбоцитов. Заболевание диагностируется в случаях, когда в миелограмме обнаруживается свыше 20% незрелых клеток. Его характерной особенностью является быстрое течение: в течение нескольких месяцев незрелые клетки начинают преобладать в составе крови, из-за чего она перестаёт выполнять свои основные функции. Состояние больного резко ухудшается, и при отсутствии лечения прогноз крайне неблагоприятен.
Онкогематологи различают несколько десятков разновидностей острого миелоидного лейкоза, которые группируются по сходным признакам:
- с типичными генетическими мутациями;
- с дисплазией, обусловившей изменение клеток;
- возникшие в результате лечения других заболеваний;
- с разрастанием миелоидного ростка на фоне синдрома Дауна;
- миелоидные саркомы;
- дендритноклеточные плазмацитоидные опухоли.
В зависимости от формы заболевания врач выбирает тактику лечения, так как продолжительность ремиссий и общий прогноз для разных видов имеют серьёзные отличия.
Симптомы
В начальной стадии острого миелобластного лейкоза симптомы практически отсутствуют, с развитием болезни у пациента развиваются:
- бледность кожи и другие признаки анемии;
- кровотечения из носа и дёсен, многочисленные кровоподтёки на коже;
- повышенная температура в пределах 37-38 градусов (субфебрильная);
- обильное выделение пота по ночам;
- сыпь на коже в виде мелких красноватых пятнышек;
- одышка даже после небольших нагрузок;
- постоянные боли в костях и суставах;
- частые простудные и другие инфекции;
- увеличенные лимфоузлы;
- резкое снижение веса без видимых причин.
Причины и факторы риска
В настоящее время неизвестно, какие именно воздействия побуждают ростки крови к злокачественным мутациям, однако онкологи хорошо изучили факторы, способствующие развитию острого миелобластного лейкоза.
- Воздействие канцерогенов. Некоторые химические соединения могут побуждать клетки к изменению. Это ряд продуктов, образующихся во время курения табака и неполного окисления жиров, многие виды промышленных выбросов, некоторые лекарственные препараты и т. д.
- Излучение. Рентгеновские лучи и другие радиоактивные, ионизирующие излучения изменяют наследственный аппарат живых клеток.
- Генетический фактор. Риск заболевания повышается в несколько раз для людей, у которых близкие родственники болели лейкозом.
- Заболевания. Некоторые болезни увеличивают вероятность рака крови. Это синдром Дауна, врождённая анемия и тромбоцитопения, нейрофиброматоз и т. д.
Диагностика
Лабораторные анализы крови и образцов костного мозга являются основными способами диагностики острого миелобластного лейкоза. Это:
- общий анализ периферической крови;
- миелограмма;
- цитохимический анализ незрелых клеток;
- иммунофенотипирование;
- цитогенетический анализ;
- молекулярно-генетический анализ;
- HLA-типирование;
- биохимический анализ крови;
- проба Реберга;
- коагулограмма.
Кроме того, пациенту назначают инструментальные исследования внутренних органов для оценки их состояния: УЗИ брюшной полости, ЭКГ, рентген грудной клетки. Впоследствии могут быть назначены другие анализы и исследования.
Лечение
Основным методом лечения острого миелобластного лейкоза является химиотерапия, которая проводится в два этапа:
- индукция — снижение количества незрелых клеток для достижения ремиссии;
- консолидация — максимальное продление ремиссии, предотвращение рецидивов, устранение остаточных явлений.
Интенсивная терапия, применяемая на этапе индукции, позволяет достигнуть ремиссии примерно в 70% клинических случаев. Но заканчивать на этом лечение категорически не следует, так как без программы консолидации у пациентов практически всегда спустя некоторое время наступает рецидив.
Консолидационный этап, в зависимости от состояния больного, включает до пяти курсов химиотерапии. Если риск рецидива достаточно высок, проводится пересадка костного мозга и/или стволовых клеток кроветворения. Лучшими донорами считаются родные братья и сёстры, особенно однояйцевые близнецы.
Кроме того, пациентам часто назначают введение эритроцитарной массы, трансфузионную терапию (переливания крови и её препаратов). Тактика лечения обычно выбирается в соответствии с возрастом пациента. Ремиссия считается достигнутой, если количество миелобластных клеток в костном мозге удаётся снизить до 20% и менее.
Прогнозы
При остром миелоидном лейкозе прогноз жизни зависит от возраста больного — после 60 лет шансы на выздоровление составляют 20-25%, тогда как у более молодых пациентов они достигают 70, а в некоторых клиниках и 90%. Ухудшают перспективы выздоровления генетические заболевания (болезнь Дауна и др.). В случае, если рак крови носит вторичный характер, возможно только паллиативное лечение.
Профилактика
Специфических способов предупреждения острого миелоцитарного лейкоза не существует. Чтобы вовремя начать лечение, необходимо регулярно проходить профилактические обследования, сдавать анализы. Пациентам, завершившим курс лечения, не рекомендуется менять климатическую зону постоянного проживания. Кроме того, им следует отказаться от физиотерапевтических процедур.
Реабилитация
Химиотерапия и особенно пересадка костного мозга создают огромную нагрузку на организм, поэтому пациент должен строго соблюдать все клинические рекомендации при остром миелобластном лейкозе, чтобы достигнуть выздоровления. Они включают процедуры выведения токсинов из крови, строгое соблюдение правил антисептики, меры по повышению иммунитета и восстановлению микрофлоры кишечника. Большое значение придаётся антистрессовой терапии и профилактике депрессии, улучшению качества сна.
Диагностика и лечение острого миелобластного лейкоза в Москве
Клиника Института ядерной медицины проводит диагностические исследования для выявления острого миелобластного лейкоза. В случае подтверждения диагноза вы можете пройти лечение у квалифицированных онкогематологов, врачей высшей категории. Регулярное участие в международных конференциях и семинарах, стажировки в зарубежных клиниках позволяют нашим специалистам овладевать самыми передовыми медицинскими методиками для успешного лечения пациентов.
Вопросы и ответы
Почему при лечении острого миелобластного лейкоза возникают побочные эффекты?
Воздействие химиопрепаратов убивает не только бластные онкоклетки, но и здоровые клетки крови, что приводит к развитию интоксикации организма, проявляющейся в тошноте, слабости, повышенной подверженности инфекциям. Чтобы минимизировать этот эффект, используют различные поддерживающие меры — переливание препаратов крови, лейкаферез и другие процедуры.
Сколько живут с острым миелобластным лейкозом?
Возможность прожить более пяти лет у пациентов с острым миелоидным лейкозом зависит от формы заболевания и возраста. В некоторых случаях выживаемость составляет менее 20%, при других формах болезни превышает 70%. Шансы на выздоровление существуют всегда, а повысить их можно, обратившись в хорошую клинику с современным медицинским оборудованием и опытными онкогематологами.
Когда проводят трансплантацию при остром миелобластном лейкозе?
Оптимальный период для трансплантации — после достижения первой ремиссии. Она показана при высоком риске рецидива, при обнаружении цитогенетических изменений в поражённых клетках, а также при наличии других заболеваний крови. Как правило, в случае успешного восстановления после пересадки рецидивов болезни не происходит.
Острый миелоидный лейкоз: что это такое, причины, симптомы и лечение
В большинстве случаев анамнез и выявляемые при осмотре симптомы сходны с таковыми при ОЛЛ. Боли в костях и выявляемые при рентгенологическом обследовании инфильтраты в них при ОМЛ менее распространены. Заболевания ЦНС встречаются очень редко. Увеличение лимфатических узлов также менее распространено, чем при ОЛЛ.
При миеломоноцитарной (М4) и моноцитарной (М5) лейкемии являются обычными инфильтраты в деснах, приводящие к «гипертрофии» десен. Кожные инфильтраты также нередки при этих формах лейкемии и связаны с высоким тотальным уровнем WBC и высоким уровнем лизозимов сыворотки крови и мочи, которые выделяются опухолью.
Наиболее распространенные диагностические признаки: бледность кожных покровов, гепатоспленомегалия, пурпура и боли в костях. Часто повышен уровень WBC, как правило, хорошо выявляются миелобласты. Для подтверждения диагноза проводят исследование костного мозга с использованием специального соответствующего окрашивания.

Морфологическая классификация острых лейкемий. Доля подтипов острых лейкемий миелоидного и моноцитарного происхождения (%).
Лечение острой миелобластной лейкемии
Индукция ремиссии: целью индукции является восстановление костного мозга и клиническая ремиссия. Чтобы этого добиться, необходима интенсивная терапия крови, тромбоцитов и применение антибиотиков в период гипоплазии, неизбежно сопровождающее химиотерапию.
Используется комбинация высоких доз цитозинарабинозида и даунорбицина. Идарубицин и митоксантрон не представляются более эффективными, чем даунорбицин. Добавление таких трех лекарств, как этопозид, флюдарабин или тиогуанин, не дает улучшения результатов. Количество бластов в крови и костном мозге обычно быстро снижается при супрессии нормального гематопоэза.
В настоящее время, когда возможно применить врачебные навыки, смертность на этой стадии составляет 10%. В период гипоплазии дальнейшая цитотоксическая терапия часто необходима, если все еще есть проявления болезни со стороны костного мозга, которые приводят к интенсификации гипоплазии и повышают риск.
Поэтому индукция ремиссии является процедурой, требующей очень хороших навыков, которую лучше проводят в учреждениях, имеющих подготовленный медицинский персонал и сиделок. Очень важен внимательный контроль жидкости и электролитного баланса, быстрое оперативное выявление и лечение инфекций. Профилактическое лечение ЦНС обычно не проводят.
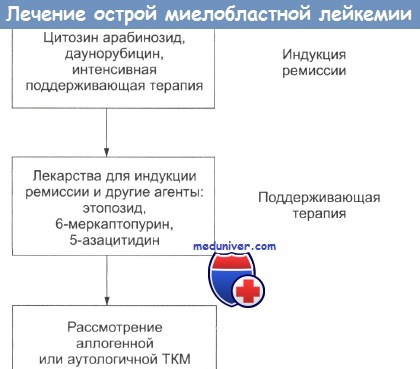
Поддерживающая терапия острой миелобластной лейкемии
Поддержание продукции элементов крови очень важно в фазе интенсивной индукции ремиссии. Трансфузия тромбоцитов оказывается наиболее действенной в предотвращении гибели от геморрагии. Показания к трансфузии тромбоцитов обсуждаются в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Переливание крови весьма важно при анемии, но его нужно избегать в ситуациях, когда WBC очень высок (выше 100 х х 109/л), поскольку могут возникнуть лейкостазы в сосудах головного мозга. Для снижения WBC перед трансфузией могут быть использованы химиотерапия и, если необходимо, лейкаферез. Применение гемопоэтических ростовых факторов описано в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Во время интенсивной терапии хорошо помогает использование подкожно вводимых внутривенных подключичных катеторов (катетер Хикмана).
Для предотвращения инфекции пациентов инструктируют, как правильно мыться, особенно аккуратно в области промежности. При выявлении сепсиса зубов и полости рта нужно немедленно приступать к лечению. Пища должна быть термически обработана и чистая — свежие салаты лучше исключить. Очень важно регулярное обследование полости рта, кожи и промежности, должны проводиться регулярные посевы для выявления патогенов, таких как Klebsiella или Pseudomonas. В некоторых случаях дается котримоксазол с профилактической целью для предотвращения развития оппортунистических инфекций, таких как Pneumocystis carinii.
У многих пациентов развивается жар, лихорадка на некоторых стадиях в период нейтропении. Лечение инфекции у больных с нейтропенией обсуждается в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта). Часто невозможно поставить бактериологический диагноз. Наиболее фатальными инфекциями являются те, которые вызваны представителями группы граммотрицательных микроорганизмов. Инфекции, появляющиеся вокруг линии Хикмана, вызывают микроорганизмы, частично присутствующие на коже в норме, такие как Staphyloccocus epidermidis и S. aureus. Для лечения этих явлений часто используют антибиотики ванкомицин и тейкопланин.
Оппортунистические инфекции являются причиной значительных затруднений в диагностике у пациентов с высокой температурой и легочными инфильтратами. Инфекции, вызванные микроскопическими грибами, Pneumocystis carinii, и менее распространенные цитомегаловирусные и другие вирусные инфекции должны быть также приняты во внимание.

После того как взяты посевы крови при приступе жара, проводится внутривенная терапия широким спектром антибиотиков. Такие режимы обычно включают аминогликозид и цефалоспорин, часто добавляют метронидазол, особенно если наблюдают ухудшение клинических проявлений через 24 ч. При выявлении легочных инфильтратов могут применяться высокие дозы котримоксазола для борьбы с Pneumocystis, амфотерицин В для подавления грибной инфекции и ацикловир для подавления герпеса.
Результаты лечения и новые подходы: Полная ремиссия наблюдается у 65% пациентов моложе 60 лет и у 50% — старше этого возраста. Поэтому развитие новых подходов к индукции ремиссии в группах с плохим прогнозом является важной областью в дальнейших исследованиях. Новые подходы включают в себя использование анти-CD33 моноклональных антител (гемтузумаб).
Более интенсивные поддерживающие режимы также изучаются и могут пролонгировать длительность ремиссии. У пожилых пациентов токсичность повышена и интенсификация режимов проблематична. Худший исход наблюдается у тех больных старше 60 лет, у которых высокий уровень WBC и плохие характеристики статуса, а также у пациентов, у которых ОМЛ развилась после миелодиспластического синдрома (9:11).
Цитогенетические изменения прогностически важны: t(q;11), 5q, inv3 — неблагоприятны, и t(8;21) — имеет благоприятный прогноз. В общем, выживаемость в течение 10-летнего периода без проявления болезни составляет около 30%.
Несмотря на то что результаты стандартной интенсивной химиотерапии при ОМЛ улучшаются, долгосрочный прогноз до сих пор остается плохим для большинства пациентов. Подходы с использованием ТКМ (особенно аллогенной) не годятся для большинства пациентов, так как ОМЛ — болезнь людей пожилого возраста. Аллогенная ТКМ обычно применяется при первом полном ответе и, по сравнению со стандартным лечением, похоже, снижает лейкемические рецидивы на 20%. Некоторые из этих положительных результатов проявляются из-за лейкемического эффекта отторжения.
Современные исследования показывают преимущество аллогенной трансплантации с долгосрочным эффектом без проявлений болезни у примерно 50% пациентов. Этому необходимо противопоставить острую смертность, особенно от аллогенной ТКМ. Показано, что аутологичная ТКМ снижает риск рецидивов. Эта процедура более широко применима, чем аллогенная ТКМ, поскольку подходящий донор не нужен. При аллогенной ТКМ обычно используются высокие дозы циклофосфамида и ТО. При аутологичной ТКМ режимы могут базироваться лишь на одной химиотерапии. Гемопоэтические ростовые факторы делают возможным повышение интенсивности лечения, не вызывая стимуляции лейкемической пролиферации.
Для пожилых пациентов в большинстве случаев есть дополнительные проблемы, связанные с сопутствующими заболеваниями, не позволяющие применить интенсивный метод. Несмотря на это, во многих исследованиях исключают пациентов старше 60 лет без достаточных оснований, и требуется более усовершенствованный метод. Возможно, аллогенная или аутологичная трансплантация более низкой интенсивности даст лучший результат.
Лечение рецидивов острой миелобластной лейкемии
Хотя индукция второй ремиссии возможна у пациентов, которые дали рецидив после прерывания лечения, такая ремиссия обычно непродолжительна. Для пациентов моложе 60 лет вторая ремиссия иногда может быть достигнута использованием высоких доз цитозинарабинозида. Для молодых людей и тех, у кого обнадеживающий прогноз, есть шанс лечения с использованием аллогенной или аутологичной ТКМ, обычно с предшествующей реиндукционной химиотерапией.
Исследования, сравнивающие аллогенную и аутологичную трансплантацию, не могут быть рандомизированы, за исключением тех двух случаев, когда донор пригоден или не пригоден к рассмотрению как суррогатная «генетическая» случайная выборка. Поэтому и технические, и клинические трудности не вносят ясности, какой метод предлагает лучший результат. Рецидивы со стороны центральной нервной системы лечат по сходной схеме как при ОЛЛ.
Лечение острой промиелоцитарной лейкемии (M3)
Острая промиелоцитарная лейкемия (ОПЛ) составляет 10% от общего количества случаев заболевания ОМЛ. Индукция ремиссии осложняется десеменированной внутрисосудистой коагуляцией в тех случаях, когда применяется цитохимическая химиотерапия. Представляется, что это происходит из-за высвобождения прокоагулянтов (цистеиновая протеиназа).
Клетки дифференцируются in vitro в ответ на полностью транс-ретиноивую кислоту (ATRA, третинон). Когда применяют ATRA для лечения пациента с ОПЛ, костный мозг медленно (в течение 2 месяцев) возвращается в норму (кроме типичного t(15;17) кариотипа) и десеменированной внутрисосудистой коагуляции не происходит. Побочные эффекты: сухая кожа, головные боли и потенциально опасный гиперлейкоцитоз (который может вызвать отек легких). Через 6 месяцев у пациентов бывают рецидивы.
Новые исследования предполагают, что химиотерапия как дополнение к лечению ATRA может дать хорошие результаты. Точка разрыва при транслокации хромосом t(15;17) расположена около гена, кодирующего а-рецептор ретиноевой кислоты на 17 хромосоме, и использование ATRA только улучшает ситуацию в тех случаях, когда у пациента имеется такая транслокация.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Острый миелоидный лейкоз: что это такое, причины, симптомы и лечение

+972 3 376 03 47

+7 499 403 30 20
Лечение острого миелоидного лейкоза в Израиле
При выборе методов лечения острого миелоидного лейкоза в Израиле принимается в расчет ряд критериев, в том числе подвид лейкоза, возраст, общее состояние здоровья и личные возможности пациента. Основным методом лечения ОМЛ является химиотерапия в различных ее видах. Такой процесс лечения рака в Израиле делится на две фазы: индукцию (улучшение) и консолидацию (закрепление). Фаза индукции Во время данной фазы лечения назначается интенсивная терапия химиотерапевтическими препаратами. Целью данного этапа является достижение ремиссии, посредством уничтожения пораженных болезнью клеток в кроветворных тканях. Фаза консолидации В этот период проводится поддерживающая терапия, фаза лечения направлена на закрепление результатов первой фаза и разрушение оставшихся лейкозных клеток. Основной задачей консолидации является снижение риска рецидива. В ходе фазе консолидации также применяются цитостатики (препараты химиотерапии).
Трансплантация костного мозга
Трансплантация костного мозга при остром миелоидном лейкозе позволяет проводить более агрессивную противоопухолевую терапию с более высокими дозами химиопрепаратов и/или облучения. При таком виде лечения, проводимом в стационаре, уничтожаются не только злокачественные клетки, но и нормальные клетки кроветворной системы, находящиеся в костном мозге. После их уничтожения производится пересадка здоровых стволовых клеток путём инфузии через крупную вену на шее или грудной области пациента. В дальнейшем из пересаженных здоровых стволовых клеток, которые могут быть аутологичными (забранными из здоровых частей собственного организма пациента) либо аллогенными (полученными от донора) образуются здоровые клетки крови. Помимо цитостатиков в лечении острого миелоидного лейкоза в Израиле также используются другие фармацевтические препараты, такие как Trisenox и ATRA. Эти лекарственные средства могут быть использованы отдельно или в комплексе с химиотерапией для индукции ремиссии подвида ОМЛ, который называется промиелоцитарный лейкоз. Данные препараты воздействуют на лейкозные клетки с определенной генной мутацией, уничтожая их или останавливая их деление. По показаниям (при поражении органов либо обнаружении метастаз) возможно проведение лучевой терапии. На время проведения курса лечения пациентам с диагнозом острый миелоидный лейкоз требуется госпитализация, поскольку лекарственные препараты помимо поврежденных болезнью кровяных клеток уничтожают и здоровые. Если курс химиотерапии был не достаточно эффективен, то его проводят повторно. Если лечение своевременно начато и верно назначено, то болезнь можно перевести в стадию длительной ремиссии, и даже полностью вылечить больного. За последние годы, с применением новых, прогрессивных методов лечения, показатели выживаемости у взрослых пациентов постоянно повышаются и уже могут достигать порядка 70 процентов.
Причины и симптомы ОМЛ
Причины острого миелоидного лейкоза
Острый миелоидный лейкоз (в т.ч. острый миелобластный лейкоз) это злокачественное заболевание костного мозга и крови. Оно начинается с костного мозга, поражает кровь, лимфатические узлы, далее печень, селезенку и ЦНС. Это один из самых распространенных лейкозов у взрослых. Термин острыйозначает быстрое развитие болезни, в противоположность хроническому лейкозу.
При остром миелоидном лейкозе происходит поражение белых кровяных клеток (лейкоцитов), которые начинают беспорядочно делиться, постепенно вытесняя другие клетки крови, а при некоторых формах острого миелоидного лейкоза и эритроциты. Злокачественные клетки заполняют пространство костного мозга и препятствуют развитию нормальных клеток крови, которые выполняют жизненно важные функции. При очень высоком уровне незрелых белых кровяных клеток, спровоцированном лейкозом, наблюдается снижение уровня тромбоцитов и гемоглобина, который находится внутри красных кровяных клеток.
Согласно классификации FAB (франко-британско-американская морфологическая классификация) выделяют 8 основных вариантов заболевания (кроме очень редких разновидностей ОМЛ):
- М0 — миелобластный лейкоз с минимальной дифференцировкой;
- М1 — миелобластный лейкоз без созревания клеток;
- М2 — миелобластный лейкоз с неполным созреванием клеток;
- М3 — промиелобластный лейкоз;
- М4 — миеломонобластный лейкоз;
- М5 — монобластный лейкоз;
- М6 — эритролейкоз;
- М7 — мегакариобластный лейкоз.
Симптомы острого миелоидного лейкоза
Несмотря на то, что острый миелоидный лейкоз протекает стремительно, его симптомы неспецифичны и на ранних стадиях могут быть сходны с гриппоподобными состояниями.
На развитие у пациента онкологического недуга, могут указывать следующие признаки:
- симптомы анемии (бледность кожных покровов, усталость, затрудненное дыхание);
- подверженность инфекционным заболеваниям (как результат недостатка лейкоцитов и, как следствие, снижение иммунитета);
- кровотечения из-за уменьшения количества тромбоцитов в крови (ссадины, синяки, кровотечения из носа);
- припухлость и кровоточивость десен;
- хроническая усталость;
- повышенное потоотделение и высокая температура;
- боли в суставах, костях;
- увеличение лимфатических узлов, печени, селезенки (на более поздних стадиях);
- миелоидная саркома.
Каждый из этих признаков может быть выражен в большей или меньшей степени, в зависимости от того, какие именно кровяные клетки вовлечены в патологический процесс, и на какой стадии он находится.
Факторы риска развития острого миелолейкоза
Ученые до сих пор не нашли достоверного ответа, почему костный мозг перестает правильно выполнятьсвою функцию: одной из предполагаемых причин называют генетические изменения в кроветворных клетках.
Однако выявлены некоторые факторы, увеличивающие вероятность возникновения ОМЛ:
- Возраст старше 55 лет. Большинство больных ОМЛ пожилые люди. В отличие от острого лимфобластного лейкоза, наиболее характерного для детского возраста, при ОМЛ дети составляют всего 10% больных.
- Воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний).
- Принадлежность к мужскому полу.
- Курение (согласно статистике, около 20% случаев заболевания связано с курением).
- Генетическая предрасположенность.
- Иные заболевания кроветворной системы в анамнезе (например, миелодиспластический синдром).
- Определенные генетически обусловленные аномалии (включая синдром Дауна,анемию Фанконии некоторые другие).
Диагностика острого миелоидного лейкоза
Первичное подозрение на ОМЛ может возникнуть по совокупности клинических признаков и на основании общего анализа крови, который показывает дефицит эритроцитов и тромбоцитов на фоне перепроизводства лейкоцитов, представленных в большинстве своем незрелыми клеточными формами. Существует несколько разновидностей заболевания, поэтому точный диагноз врач может установить только после проведения комплексного обследования.
На основании анализа крови можно лишь предположить наличие лейкемии, однако для подтверждения диагноза производится забор небольшого количества клеток костного мозга. Так как существует несколько разновидностей острого миелоидного лейкоза то что бы установить точный диагноз полученный образец отправляется на исследование в лабораторию для последующих анализов:
- исследование образца ткани под микроскопом с целью определения вида пораженных клеток и стадии их развития;
- анализ ПЦР (полимеразной цепной реакции);
- иммуноцитохимический анализ для обнаружения определенного типа белка, который находится на поверхности злокачественных клеток (позволяет точно определить тип пораженных клеток);
- цитогенетический анализ для обнаружения возможных нарушений в строении и функции хромосом, характерных для лейкозов. Если неправильные хромосомы найдены, тест может показать тип лейкоза.
После консультации и всех необходимых исследований, онкогематолог определит тип и стадию развития лейкоза. Как можно более точная диагностика в данном случае важна для выбора дальнейшего наиболее подходящего метода лечения острого миелоидного лейкоза для конкретного пациента.
Время пребывания в Израиле для выполнения вышеуказанного плана в амбулаторном режиме 5-6 рабочих дней.


