Симптомы, причины и методы лечения наследственной гиперхолестеринемии
 Склонность к повышенному холестерину может передаваться по наследству. Заболевание называется «наследственная (семейная) гиперхолестеринемия».
Склонность к повышенному холестерину может передаваться по наследству. Заболевание называется «наследственная (семейная) гиперхолестеринемия».
Согласно МКБ-10 (международному классификатору болезней) патология имеет код Е-78 и относится к группе заболеваний, связанных с повышением уровня холестерина в крови .
В этой статье мы рассмотрим основные проявления семейной гиперхолестеринемии, способы диагностики, лечения и последствия при отсутствии медикаментозной помощи.
Что из себя представляет семейная гиперхолестеринемия?
Это заболевание, которое передается наследственным путем. Оно связано с нарушением регуляции жирового обмена. В крови больного человека повышается холестерин, при чем первые симптомы появляются в большинстве случаев до наступления подросткового возраста. К 30 годам у больного формируется устойчивая форма атеросклероза со всеми вытекающими последствиями: сердечной недостаточностью, гипертонией и угрозой инфаркта или инсульта.

Образование холестериновых бляшек.
Лечится заболевание затруднительно, так как повреждены глубинные механизмы регуляции жирового обмена. Но современная медицина использует новейшие технологии очистки крови, они позволяют спасти жизнь многим пациентам и избежать ранней смерти от инфаркта миокарда.
Причины появления
Причины возникновения генетических дефектов не изучены. Предполагается влияние следующих факторов на генотип человека:
- радиация;
- употребление в пищу генетически модифицированных продуктов питания;
- сопутствующие генетические болезни.
Семейная гиперхолестеринемия связана с врожденным дефектом 19-й хромосомы. Заболевание передается от одного родителя (гетерозиготная форма) или от двух сразу (гомозиготная форма). Последний тип особенно тяжело переносится, больные редко доживают до 30 лет без пересадки печени.
Вероятность проявления болезни у ребенка высокая, даже при наличии патологии у родственников третьей линии родства. Если в семейном анамнезе присутствует гиперхолестеринемия, любого новорожденного малыша в роду необходимо проверять на уровень холестерина с рождения каждый год.
Предположение о присутствии болезни делается на основе данных липидограммы (расширенного анализа крови) и сопутствующих симптомов гиперхолестеринемии.
Симптомы и признаки
Семейная гиперхолестеринемия проявляется следующим образом:
- на анализе крови (развернутой липидограмме) повышен холестерин. При этом повышаются разные фракции: общий холестерин, ЛПНП (транспортные формы холестерина, именно они формируют атеросклеротические бляшки ), триглицериды (продукты расщепления жиров пищи);
- стенокардия (при физической нагрузке у больного колит сердце и развивается одышка);
- гипертония;
- ранние инфаркты и инсульты;

Ксантеномы и ксантомы при семейной гиперхолестеринемии.
внешние проявления: ксантомы (пузырьки на коже, внутри которых находится жир), старческая дуга (образование желтых пятен вокруг роговицы), ксантеномы (кожа век наливается мировым содержимым);
По наличии яркой клинической картины не трудно сделать вывод о наличии гиперхолестеринемии. Вышеперечисленные симптомы проявляются в детском возрасте. Окончательный диагноз ставится на основании анализа липидограммы и других методов.
Диагностика
Кроме биохимического анализа крови, на котором врач выясняет содержание различных фракций холестерина, существуют дополнительные методы исследования. Они используются при затруднении в постановке диагноза.
- Доплерография. Исследование поверхности стенок сосудов. Оценивается толщина эпителия, благодаря чему холестериновые бляшки легко обнаруживаются.
- Развернутый генетический анализ. Оценивается состояние каждого отдельно взятого гена.
- Генетический анализ родственников больного (до третьей линии родства).
- Ангиография. Исследование сосудов с помощью компьютерной томографии или рентгеновского излучения. Предварительно в исследуемую область вводится контрастное вещество. На снимке хорошо видны стенки сосудов, утолщения, холестериновые бляшки.
- Анализ уровня гормонов щитовидной железы. Это обязательный этап дифференциальной диагностики. Причиной повышения холестерина может быть не наследственная гиперхолестеринемия, а врожденная патология щитовидной железы. Эту болезнь нужно исключить или подтвердить, чтобы начать лечение.
Комплексное лечение наследственной гиперхолестеринемии
Лечение зависит от типа наследования. Если гиперхолестеринемия была передана только от одного родителя, то она лечится легко. Применяются лекарственные препараты, снижающие холестерин, диета и лечебная физкультура. Больные живут долго, но к 50-70 годам у них неминуемо развивается сердечная недостаточность и гипертония.
Если заболевание передано от обоих родителей, состояние больного очень тяжелое. Лечение медикаментами практически не дает результата, нужны более серьезные методы лечения: пересадка печени, периодический плазмаферез (очистка крови с помощью аппаратов от избыточного холестерина). Лекарства используются как поддержка основной терапии.
Принципы питания и диета
Основной принцип питания при повышении холестерина – это исключение продуктов, содержащих животные жиры, и замена их растительными.

Полезные и вредные жиры.
Требуется отказаться от:
- жирного мяса, сала, колбасы;
- жирных молочных продуктов;
- любых жареных блюд, копченостей;
- майонеза, сметаны;
- субпродуктов;
- кофе, спиртных напитков;
- сладкого;
- курения.
Животные жиры заменяют растительными, они входят в состав:
- орехов ;
- растительных масел ;
- авокадо;

- чеснока;
- льняного семени ;
- круп (в минимальном количестве).
Все эти продукты должны быть активно включены в ежедневный рацион. Также не стоит забывать и о рыбе. Этот продукт особенно полезен при повышенном холестерине.
В рыбе содержатся полиненасыщенные жирные кислоты: омега-3 и др. Эти вещества растворяют избыточный «плохой» холестерин в бляшках. Рыбу нужно употреблять минимум 3-4 раза в неделю. При этом отдавать предпочтение жирным сортам : форели, семге, сельди, скумбрии.
Среди напитков особо полезны: настой шиповника, чай с мятой, зеленый чай.
Образ жизни
Отсутствие физической активности способствует ухудшению состояния больного. Обязательно согласуйте с врачом допустимый для вас уровень нагрузки и занимайтесь спортом не менее 30-40 минут в день. Хороший кровоток способствует усиленном питанию тканей, растворяет холестериновые бляшки и препятствует развитию ишемии.
Отдельное внимание уделяйте полноценному сну. Он должен занимать не менее 8 часов в день. Но больше ориентируйтесь на свое состояние. Вы должны чувствовать себя отдохнувшим – это самое важное.
Медикаментозные препараты
С реди медикаментов используются препараты следующих групп:
реди медикаментов используются препараты следующих групп:
- секвестранты желчных кислот («Колестирамин», «Колестипол»);
- фибраты («Фенофибрат», «Липанор»);
- статины («Аторвастатин», «Розувастатин»).
Первые две группы разрешены к применению у детей. Статины в детском возрасте назначаются редко из-за вероятности развития побочных эффектов. У взрослых на сегодняшний день «Розувастатин» является самым часто назначаемым препаратом. Он хорошо переносится и отличается высокой эффективностью.
К какому врачу обращаться?
Заболевание выявляется в ходе обычных анализов. Их назначает педиатр или терапевт (у взрослых людей). Больных с предположительным диагнозом «семейная гиперхолестеринемия» отправляют на дополнительные исследования в кардиологу. Он ведет их на протяжении всей жизни, постоянно контролирует состояние сердечно-сосудистой системы и уровень холестерина в крови.
Заключение
В настоящее время семейная гиперхолестеринемия – это не приговор. Медицина располагает высокоэффективными методами лечения болезни, больные живут долго и полноценно. Но единственным условием успешной терапии является соблюдение диеты и ведение здорового образа жизни. Без ограничений в питании любое лечение будет не эффективным.
Семейная гиперхолестеринемия – что это за болезнь, причины и лечение
Наследственное генное расстройство, ведущее к агрессивным, преждевременным патологиям сердечно-сосудистой системы. Данная патология также известна как гиперлипопротеинемия 2 типа.

Кровь по своим свойствам схожа с водой, а вода и жир, как известно, смешиваются плохо. Поэтому холестерин с триглицеридами переносятся протеинами, в специальной белковой оболочке.
Данные комплексы называются липопротеинами, от плотности, размера, концентрации холестерина различают: хиломикроны (ХМ), липопротеиды очень низкой плотности (ЛПОНП, VLDL), липопротеиды низкой плотности (ЛПНП, LDL), липопротеиды промежуточной плотности (ЛППП, IDL), липопротеиды высокой плотности (ЛПВП, HDL).
ЛПВП характеризуют как «хороший» холестерин, который служит строительным материалом клеточной мембраны. Норма по этому биохимическому параметру составляет 0,86-2,28 ммоль/л у женщин, 0,72-1,63 ммоль/л – у мужчин. Считается, что чем выше данный показатель, тем ниже риск развития инфарктов или инсультов.
В свою очередь, ЛПНП отражает, сколько в крови «плохого холестерина», который накапливается на сосудистой стенке. ЛППП являются переходными продуктами превращения ЛПОНП в ЛПНП, при этом ЛПОНП и ХМ отражают уровень триглицеридов, норма которых зависит от возраста, пола, а повышение уровня данных веществ может свидетельствовать о наличии болезни.
Причины
Семейная гиперхолестеринемия – генетически опосредованная патология, в основе которой лежат дефекты аллелей гена рецептора ЛПНП. Эта мутация определяет неспособность печени метаболизировать (расщеплять) избыток ЛПНП.
Если человек наследует генетическую мутацию от одного родителя, то имеет место гетерозиготная гиперхолестеринемия (встречается у 1 из 250 человек). Если же мутантные гены наличествовали у обоих родителей, то у ребенка диагностируется более тяжелая форма – гомозиготная гиперхолестеринемия (наблюдается в 1 из 160 000 случаев).
Таким образом, уровень холестерина у больного растет до чрезвычайно высоких значений. Со временем повышенное содержание данного соединения может привести к полному сужению просвета коронарных или каротидных артерий. Чем дольше у человека наблюдается высокий уровень ЛПНП, тем выше вероятность ишемических патологий. У взрослых пациентов этот показатель составляет от 190 до 400 мг/дл. У детей концентрация ЛПНП около 160 мг/дл.
Значимую роль в развитии гиперхолестеринемии играют:
- диета с высоким содержанием насыщенных жиров;
- заболевания почек, гипотиреоз, сахарный диабет;
- прием лекарственных препаратов, содержащих эстроген, кортикостероиды, ретиноиды, ингибиторы протеазы, тиазидные диуретики, бета-блокаторы;
- избыточная масса тела;
- чрезмерное употребление алкоголя;
- курение;
- гиподинамия, гипокинезия;
- использование стероидов, некоторых оральных контрацептивов.
Опасность заболевания
При гиперхолестеринемии, содержание ЛПНП крайне высокое, что приводит к накоплению жировой ткани в сосудах, сужению их просвета, вплоть до критических величин (атеросклероз). Этот процесс начинается до рождения, может привести к сердечно-сосудистым заболеваниям, острой коронарной недостаточности, инсульту. Вероятность инфаркта миокарда у человека с гиперхолестеринемией до 50 лет составляет 50%!
Сопутствующие факторы ишемической болезни сердца, инсульта, инфаркта – курение, большая масса тела, высокое артериальное давление, сидячий образ жизни. Наряду с медикаментозным лечением важным являются диета, здоровый образ жизни, отказ от табака, спиртного.
Симптомы
Признаками гиперхолестеринемии, которые могут обнаруживаться уже в юном возрасте, являются:
- высокий уровень общего холестерина ЛПНП;
- наличие у родственников высокого уровня общего холестерина, а также инфарктов или инсультов в молодом возрасте;
- повышенный, устойчивый к лекарственной терапии уровень ЛПНП у одного или обоих родителей;
- ксантомы (кожные или сухожильные атеросклеротические отложения);
- ксантелазмы (атеросклеротические отложения на веках);
- липемическая дуга роговицы (отложение бляшек вокруг роговицы глаза);
У людей с гомозиготной гиперхолестеринемией возникновение ксантом на коленях, локтях, коже, сухожилиях происходит в раннем возрасте, даже на первом году жизни, а острый инфаркт или инсульт может произойти до 30 лет.
Основные методы лечения
Диагноз может быть определен на основании наружного осмотра, лабораторных анализов. При физическом обследовании могут обнаруживаться кожные, сухожильные ксантомы, ксантелазмы или отложения холестерина вокруг роговицы глаза. Лабораторные исследования включают ЭКГ, УЗИ сердца, анализ липидограммы (общий холестерин выше 250 мг/дл, уровень ЛПНП выше 200 мг/дл) , исследование генетического полиморфизма (выявление мутации гена рецептора ЛПНП).

Атеросклероз является заболеванием, при котором жировая ткань (атеросклеротическая бляшка) собирается вдоль стенок артерий, может полностью блокировать просвет сосуда. Главная мишень лечения – снижение риска развития атеросклеротической болезни путем уменьшения уровня циркулирующего ЛПНП в плазме крови.
Первым этапом лечения при гетерозиготной форме гиперхолестеринемии является изменение диеты со снижением общего количества потребляемых ежедневно жиров до 30% от калорийности суточного рациона. Необходимо сократить количество мясных блюд (свинина, говядина, баранина), исключить сливочное масло, цельное молоко, сыры, яичные желтки, другие источники животных жиров. Также важным является отказ от курения, употребления спиртных напитков.
Следующая стадия на пути к снижению массы тела – повышение ежедневной двигательной активности. Показаны бег, плавание, езда на велосипеде, аэробные упражнения, занятия в тренажерном зале.
Кроме диеты, снижения веса, физических упражнений необходима лекарственная терапия, поскольку изменение только образа жизни не в состоянии уменьшить уровень холестерина до безопасной для здоровья величины. Наиболее результативными лекарственными средствами, считаются «статины» Правастатин, Симвастатин, Аторвастатин, Розувастатин – препараты, угнетающие фермент ГМГ-КоА-редуктазу (HMG-CoA), который отвечает за образование холестерина. Эти медикаменты достаточно хорошо зарекомендовали себя при гиперхолестеринемии, однако перед их применением необходимо обязательно проконсультироваться с врачом.
Другая группа гиполипидемических препаратов – секвестранты желчных кислот – вещества, связывающие образующиеся в печени желчные кислоты и, тем самым, заставляя организм вырабатывать их в большем объеме, расходуя на это избыточный холестерин. Положительное действие оказывают ингибиторы абсорбции холестерина (например, Эзетимиб), затрудняя его всасывание из кишечника и, тем самым, снижая концентрацию в крови, а также гемфиброзил, фенофибрат, никотиновая кислота.
Лица, имеющие гомозиготную форму болезни, нуждаются в более серьезном лечении, так как лекарственная терапия недостаточна. Этим людям может потребоваться периодический аферез ЛПНП – терапевтическая процедура «очистки» крови. Использование афереза позволяет остановить процессы склероза, улучшить функцию сосудистого эндотелия – 50-60% случаев.
Лечение детей и подростков
Краеугольным камнем в терапии детей, больных семейной гиперхолестеринемией, являются статины. Эти препараты не влияют на физическое или умственное развитие растущего организма. Целью лечения является снижение уровня ЛПНП на 50-70 % от исходного уровня (до 130 мг/дл). Ряд ведущих специалистов считают целесообразным использование медикаментозной терапии до 8-10 лет. Выполнение афереза липопротеинов низкой плотности у детей является технически сложно осуществимой процедурой, но может быть использовано при гомозиготной форме.
Гиперхолестеринемия и беременность
Данное заболевание является аутосомно-доминантным расстройством. Шансы возникновения болезни возрастают в два раза при наличии мутантного гена у матери и отца.
Беременность протекает с сопутствующим подъемом концентрации холестерина в плазме на 25-50% по сравнению с их обычным содержанием. Это обусловлено прекращением приема препаратов, снижающих уровень липидов, во избежание тератогенного эффекта. Для противодействия резкому повышению ЛПНП рекомендован переход к диетам с практически полным отсутствием животных жиров.
Прогноз развития осложнений
Возникновение ишемической болезни сердца у больных гиперхолестеринемией, не имеющих диагноза «атеросклеротическая болезнь», определяется следующим рядом факторов:
- Артериальная гипертензия (систолическое давление ≥ 140 мм рт. ст.);
- Потребление табачных изделий (любое количество за прошлый месяц);
- Уровень ЛПВП ниже 40 мг/дл;
- Мужчины и женщины 45 лет и старше;
- Наличие в семье отрицательной истории: клиническая ишемическая болезнь или внезапная смерть моложе 55 лет по мужской линии или женщин моложе 65-летнего возраста.
В свою очередь, содержание ЛПВП 65 мг/дл и более – это благоприятный фактор, уменьшающий вероятность возникновения ишемической болезни.
Риск появления осложнений может быть значительно снижен при своевременном использовании медикаментозной терапии, направленной на уменьшение содержания холестерина в плазме. Установлено, что понижение этого органического вещества на 1% снижает риск склерозирования коронарных артерий на 2%.
Контроль массы тела, использование диет с низким содержанием жиров, высокая повседневная физическая активность оказывают значительный эффект на концентрацию общего холестерина, повышают качество и продолжительность жизни.
Семейная гиперхолестеринемия – симптомы, лечение и рекомендации

Наследственная (семейная) гиперхолестеринемия – это генетическая проблема, которая связана с повышенным уровнем холестерина в крови и высоким риском сердечно-сосудистых заболеваний.
Лечение семейной гиперхолестеринемии включает диету, регулярные физические упражнения и прием профилактических препаратов, снижающих холестерин. Это заболевание также известно как семейная гиперлипидемия, гиперхолестеринемический ксантоматоз или мутация рецепторов ЛПНП.
Холестерин является естественным компонентом клеточных мембран. Он необходим для многих биохимических процессов в нашем организме, включая синтез гормонов. Холестерин мы получаем преимущественно из животной пищи. Некоторое количество холестерина вырабатывается нашей печенью.
Холестерин крови традиционно разделяют на «плохой» и «хороший». К «плохому» холестерину относятся липопротеины низкой плотности, или ЛПНП. Именно они отвечают за развитие атеросклероза – патологической закупорки артерий. Под «хорошим» холестерином подразумевают липопротеины высокой плотности (ЛПВП), которые держат уровень ЛПНП под контролем и способствуют снижению риска сердечно-сосудистых заболеваний.
Семейная гиперхолестеринемия – это наследственное заболевание, которое отвечает за 10% болезней коронарных артерий, возникающих в раннем возрасте, у активных людей моложе 55 лет. Причиной семейной гиперлипидемии является мутация гена, которая встречается у одного из 200-300 человек.
Факторы риска семейной гиперхолестеринемии включают:
• История этого заболевания в семье.
• Сердечные приступы в раннем возрасте у родственников.
• Высокий уровень ЛПНП у одного или обоих родителей, особенно если он устойчивый к медикаментозной терапии.
Проявления болезни
Высокий уровень холестерина в крови сам по себе не вызывает никаких симптомов. Человек даже не догадывается о своей проблеме, пока не сдаст анализы крови.
Симптомы этого заболевания могут быть следующими:
• Высокий уровень холестерина в крови пациента
• Холестериновые отложения на коленях, локтях и ягодицах – ксантомы.
• Боль в груди, вызванная сужением коронарных сосудов – стенокардия.
• Инфаркты, которые случаются в относительно раннем возрасте.
Механизм семейной гиперхолестеринемии
Холестерин доставляется к клеткам с током крови. Молекулы ЛПНП прикрепляются к особым клеточным рецепторам, будучи как бы созданными для них (по принципу «ключ к замку»). Благодаря наличию этих рецепторов холестерин проникает в клетки и выполняет свои природные функции.
Ген в 19-й хромосоме, называемый LDLR-геном, кодирует эти клеточные рецепторы. При семейной гиперхолестеринемии у больных наследуется мутация LDLR-гена, которая нарушает развитие холестериновых рецепторов, их количество и структуру. Это означает, что ЛПНП недостаточно хорошо усваиваются клетками, оставаясь в свободном виде в кровотоке. Высокий уровень ЛПНП в крови приводит к развитию атеросклероза – основной причины инфарктов и других тяжелых заболеваний.
Наследование семейной гиперхолестеринемии
Семейная гиперхолестеринемия – это так называемое аутосомно-доминантное заболевание. В большом количестве случаев дефектный ген наследуется от одного носителя; в редких случаях носителями являются оба родителя.
1. Дефектный ген у одного из родителей.
Если один из родителей является носителем одного нормального и одного дефектного гена в паре, то каждый ребенок имеет 50% вероятность наследования одного мутировавшего гена. Риск развития заболеваний коронарных сосудов в раннем возрасте зависит от возраста и пола больного ребенка:
• У 50% мужчин с этим заболеванием болезни коронарных артерий развиваются до того, как они достигают 50-летнего возраста.
• Все 100% мужчин, рожденных от носителя семейной гиперлипидемии, будут страдать коронарными заболевания к 70 годам.
• Примерно у 85% таких мужчин может случиться инфаркт миокарда до достижения ими 60-летнего возраста.
• У 12% женщин, наследовавших эту мутацию, возникнут заболевания коронарных артерий до 50-летнего возраста. Около 74% из них будут страдать коронарными заболеваниями к 70 годам.
2. Дефектный ген у обоих родителей.
В этом случае прогноз более пессимистичный – каждый четвертый ребенок (25%) наследует сразу два дефектных гена в паре. При этом у ребенка развиваются тяжелые коронарные заболевания в первые десятилетия жизни, даже в детском возрасте. Эта форма семейной гиперхолестеринемии устойчива к лечению. Несмотря на все меры, риск сердечного приступа остается очень высоким. У больных может наблюдаться интенсивное отложение избыточного холестерина под кожей – многочисленные ксантомы на коленях, локтях, ягодицах.
Диагностика заболевания
Диагноз семейной гиперхолестеринемии устанавливается по результатам многих тестов, среди которых:
• Физический осмотр.
• Анализы крови на холестерин.
• Исследование сердца (стресс-тест).
• Генетический анализ для подтверждения.
Лечение семейной гиперхолестеринемии
Поскольку это заболевание наследственное, то полного излечения от него нет. Терапия направлена на снижение риска заболеваний коронарных артерий и инфаркта.
• Изменение рациона. Больным настоятельно рекомендуется уменьшить потребление продуктов, которые содержат холестерин и насыщенные жиры. Также полезно есть больше клетчатки – свежие фрукты, овощи. После 3-4 месяцев такой диеты врач проводит повторные анализы, чтобы определиться с дальнейшими мерами. В любом случае, диета – это важнейшая составляющая лечения!
• Растительные стеролы и станолы. Эти вещества по структуре похожи на холестерин, но они не усваиваются клетками организма. Исследования показали, что употребление стеролов и станолов приводит к снижению уровня холестерина в крови. Источниками этих веществ являются кукуруза, рис, орехи, растительные масла.
• Упражнения. Регулярные физические упражнения способствуют снижению уровня холестерина, что подтверждается многочисленными исследованиями.
• Контроль массы тела. Ожирение – это очень существенный фактор риска. Поддержание нормального индекса массы тела (ИМТ) – это одна из основных целей терапии. Кроме снижения риска атеросклероза, борьба с ожирением поможет уменьшить вероятность сахарного диабета и других заболеваний.
• Отказ от курения. Токсичные компоненты табака инициируют первичное повреждение сосудов, с которых начинается атеросклероз и постепенная закупорка артерий.
• Медикаментозная терапия. У весьма небольшого процента больных семейной гиперлипидемией получается снизить свой холестерин без лекарств. В подавляющем большинстве случаев больным нужен постоянный прием специальных препаратов, таких как статины (аторвастатин, симвастатин, ловастатин).
• Другие методы лечения: аферез ЛПНП, представляющий собой очищение крови от липопротеинов через специальный аппарат.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Семейная гиперхолестеринемия – факторы наследования, симптомы и лечение
Этиология и встречаемость семейной гиперхолестеринемии. Семейная гиперхолестеринемия (MIM №143890) — аутосомно-доминантное заболевание метаболизма холестерина и липидов, вызываемое мутациями в гене LDLR. Семейная гиперхолестеринемия встречается во всех расах и имеет распространение 1 на 500 в большинстве европеоидных популяций. Это составляет чуть меньше 5% всех пациентов с гиперхолестеринемией.
Патогенез семейной гиперхолестеринемии
Рецептор ЛПНП, трансмембранный гликопротеид, преимущественно экспрессирующийся в печени и коре надпочечников, играет ключевую роль в гомеостазе холестерина. Он связывает аполипопротеин В-100, единственный белок ЛПНП, и АроЕ, белок ЛПОНП, липопротеинов средней плотности, остатков хиломикронов и некоторых ЛПВП. Рецепторы ЛПНП печени захватывают из кровотока приблизительно 50% липопротеинов промежуточной плотности и 66-80% низкой плотности за счет эндоцитоза; остаток захватывается недостаточно изученным путем, не зависящим от рецептора ЛПНП.
Мутации, связываемые с семейной гиперхолестеринемией, наблюдают в гене LDLR; от 2 до 10% таких мутаций — большие инсерции, делеции или перестройки, вызванные рекомбинацией между повторами Alu в пределах гена LDLR. Некоторые мутации — доминантные. Большинство мутаций достаточно редкие, хотя некоторые популяции — например, ливанцы, французские канадцы, южноафриканские индийцы, южноафриканские евреи ашкенази и африканеры (жители ЮАР голландского происхождения) имеют общие мутации и высокое распространение болезни из-за эффекта родоначальника.
Гомозиготные или гетерозиготные мутации в гене LDLR уменьшают эффективность эндоцитоза ЛПНП и липопротеинов средней плотности и вызывают накопление ЛПНП плазмы за счет увеличения их синтеза из липопротеинов средней плотности и уменьшения печеночного захвата. Высокий уровень ЛПНП в плазме вызывает атеросклероз, увеличивая захват ЛПНП через рецептор-независимые пути, например эндоцитоз окисленных ЛПНП макрофагами и гистиоцитами.
Моноциты, проникающие через интиму артерий и захватывающие ЛПНП, образуют пенистые клетки и выбрасывают цитокины, вызывающие пролиферацию гладкомышечных клеток артериальной стенки. Первоначально гладкомышечные клетки производят достаточно коллагена и матричного белка, чтобы сформировать над пенистыми клетками волокнистый колпачок; но, поскольку пенистые клетки продолжают эндоцитоз окисленных ЛПНП, в конечном счете, они прорываются через колпачок в просвет артерии и инициируют образование тромба. Такое образование тромба — основная причина инсультов и инфарктов миокарда.
Окружающая среда, пол и генетический фон модифицируют эффект мутаций рецептора ЛПНП на их уровень в плазме, и тем самым частоту возникновения атеросклероза. Основной средовой модификатор уровня ЛПНП в плазме — диета; в Тунисе большинство гетерозигот по семейной гиперхолестеринемии имеют уровень ЛПНП в диапазоне «нормы» для жителей США и редко страдают сердечно-сосудистыми болезнями и ксантомами.
Аналогично китайские гетерозиготы по семейной гиперхолестеринемии, проживая в Китае, редко имеют ксантомы и сердечно-сосудистую патологию, тогда как китайцы, гетерозиготы по семейной гиперхолестеринемии, проживающие в западных странах, имеют клинические проявления, сходные с гетерозиготами по семейной гиперхолестеринемии европейского происхождения. Пищевой холестерин подавляет синтез рецепторов ЛПНП и тем самым поднимает уровень ЛПНП в плазме; этот эффект усиливается насыщенными жирными кислотами, например пальмитиновой (из молочных продуктов), и ослабляется ненасыщенными жирными кислотой, например олеиновой и линолевой.
Поскольку аналогичная диета неодинаково поднимает уровень ЛПНП среди разных пациентов, на метаболизм ЛПНП также должны влиять и другие средовые и генетические факторы. Некоторые семьи с семейной гиперхолестеринемией передают другой доминантный локус, уменьшающий уровень ЛПНП в плазме, что подтверждает наличие генетического модификатора.
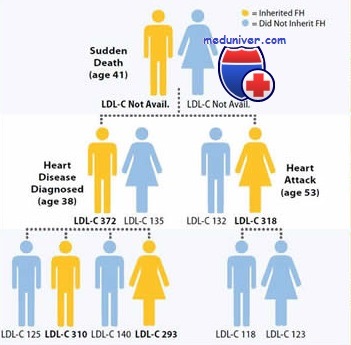
Фенотип и развитие семейной гиперхолестеринемии
Гиперхолестеринемия, самый ранний симптом при семейной гиперхолестеринемии, обычно появляется уже при рождении и остается единственным клиническим симптомом в первом десятилетии жизни у гетерозиготных пациентов; во всех возрастных периодах концентрация холестерина в плазме выше 95-го процентиля у более чем 95% пациентов. «Старческая» дуга роговицы и ксантомы сухожилий начинают появляться к концу второго десятилетия жизни, к моменту смерти уже 80% гетерозигот по семейной гиперхолестеринемии имеют ксантомы. Почти 40% взрослых пациентов имеют рецидивирующие непрогрессирующие полиартриты и тендосиновиты.
Подсчитано, что развитие ИБС среди гетерозигот по семейной гиперхолестеринемии зависит от возраста и пола. Чаще всего при отсутствии лечения концентрация холестерина превышает 300 мг/дл.
Гомозиготная форма семейной гиперхолестеринемии проявляется ксантомами сухожилий и дугой роговицы уже на первом десятилетии жизни. Без энергичного лечения гомозиготная семейная гиперхолестеринемия обычно летальна к возрасту 30 лет. Концентрация холестерина без лечения колеблется между 600 и 1000 мг/дл.
Особенности проявлений семейной гиперхолестеринемии:
• Возраст начала: для гетерозигот — молодость или средний возраст; для гомозигот — детство
• Гиперхолестеринемия
• Атеросклероз
• Ксантомы
• Старческая дуга
Лечение семейной гиперхолестеринемии
Повышение холестерина ЛПНП плазмы крови и наличие в семейном анамнезе гиперхолестеринемии, ксантом или ранней ИБС заставляет предположить диагноз семейной гиперхолестеринемии. Тем не менее подтвердить диагноз трудно, поскольку для этого нужно определить функции рецептора ЛПНП в фибробластах кожи или мутации в гене LDLR. В большинстве популяций большое количество мутаций в гене LDLR затрудняет прямой анализ ДНК, если не подозревается конкретная мутация.
Тем не менее отсутствие ДНК-подтверждения не создает помех для оказания помощи пациентам с семейной гиперхолестеринемией, поскольку окончательный молекулярный диагноз не дает прогностической или терапевтической информации, в основном зависящей от семейного анамнеза и уровня холестерина в плазме.
Независимо от того, семейная это гиперхолестеринемия или нет, все пациенты с повышенным уровнем холестерина ЛПНП требуют энергичных мер по нормализации концентрации для уменьшения риска ИБС. Тщательная нормализация уровня холестерина может предохранить и обратить развитие атеросклероза. Гетерозиготам по семейной гиперхолестеринемии необходимо строжайшее соблюдение высокоуглеводной диеты с резким уменьшением потребления жиров, обычно приводящей к 10-20% снижению уровня холестерина ЛПНП.
Поскольку такого уменьшения обычно недостаточно, пациентам также назначают лечение одним из трех классов лекAPCтвенных средств (или их комбинацией): секвестрантами желчных кислот, статинами (ингибиторы 3-гидрокси-3-метилглутарил КоА редуктазы) и никотиновой кислотой. Текущие рекомендации — начало лекарственной терапии в 10-летнем возрасте у пациентов с концентрацией холестерина ЛПНП выше 190 мг/дл и отрицательным семейным анамнезом по ранней ИБС, и для пациентов с уровнем холестерина ЛПНП выше 160 мг/ дл с положительным семейным анамнезом.
У гомозигот по семейной гиперхолестеринемии уровень холестерина плазмы можно уменьшить до 70% с помощью плазмафереза. Терапевтическая эффективность плазмафереза повышается, если его проводить на фоне энергичной терапии статинами и никотиновой кислотой. В редких случаях проводят пересадку печени.
Показатели зависимости ИБС и смерти от возраста и пола (в %) у гетерозигот по семейной гиперхолестеринемии 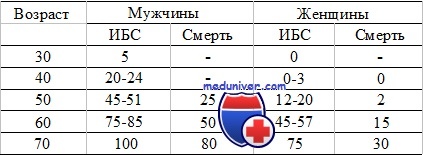
Риски наследования семейной гиперхолестеринемии
Поскольку семейная гиперхолестеринемия — аутосомно-доминантное заболевание, каждый ребенок больного родителя имеет 50% шанс унаследовать мутантный аллель гена LDLR. Без лечения гетерозиготы по семейной гиперхолестеринемии имеют 100% риск развития ИБС к 70 годам для мужчин и 75% риска для женщин. Постоянное лечение заметно уменьшает этот риск, нормализуя концентрацию холестерина в плазме.
Пример семейной гиперхолестеринемии. У Л.Л., ранее здорового 45-летнего французского канадца, произошел инфаркт миокарда. У него была небольшая ксантома в ахилловом сухожилии справа. У его брата также была ИБС; его мать, бабушка по матери и два дяди по матери умерли от осложнений ИБС. Кроме семейного анамнеза и пола, факторы риска по ИБС и атеросклерозу для Л.Л. включали повышенный уровень ЛПНП, небольшое ожирение, малую физическую активность и курение. На основе семейного анамнеза заподозрена аутосомно-доминантная форма гиперхолестеринемии.
В подтверждение этого подозрения при молекулярном анализе обнаружено, что он гетерозиготен по делеции 5′-конца гена рецептора ЛПНП (LDLR), эту мутацию обнаруживают у 59% французских канадцев с семейной гиперхолестеринемией. Обследование детей Л.Л. показало, что у двоих из трех детей уровень ЛПНП повышен.
Кардиолог сказал Л.Л., что дополнительно к лекарственной терапии эффективное лечение его ИБС требует изменения диеты и образа жизни, т.е. снижения в рационе питания насыщенных жиров и холестерина, повышения физической активности, снижения массы тела и прекращения курения. Больной не последовал этим рекомендациям и умер годом позже от повторного инфаркта.
Семейная гиперхолестеринемия ( Наследственная гиперхолестеринемия , Первичнся гиперхолестеринемия )
Семейная гиперхолестеринемия (СГХС) – наследственная патология, характеризующаяся выраженным повышением количества липопротеинов низкой плотности (ЛПНП) в кровотоке и высоким риском раннего развития ишемической болезни сердца. В большинстве случаев протекает бессимптомно. Иногда отмечается боль в груди, волдыри на руках, коленях и вокруг глаз, сухожильные и подкожные отложения холестерина. Основные методы диагностики – сбор наследственного анамнеза, анализ крови на общий холестерин и ЛПНП. Для лечения используется гиполипидемическая диета, регулярные физические нагрузки, медикаментозная коррекция липидоснижающими препаратами, аферез атерогенных липопротеидов.
МКБ-10
Общие сведения
Синонимы семейной гиперхолестеринемии – первичная, наследственная гиперхолестеринемия. Является не самостоятельным заболеванием, а состоянием предрасположенности к сердечно-сосудистым болезням – атеросклерозу сосудов, ИБС, острому инфаркту миокарда. Данные о распространенности СГХС имеют большой разброс, поскольку во многих случаях патология остается недиагностированной. Частота гетерозиготной формы, при которой у пациента имеется один дефектный ген из пары, составляет 1 случай на 108-300 человек. Гомозиготная форма, характеризующаяся наличием двух мутационных генов в аллели, протекает тяжелее и встречается гораздо реже – у 1 человека из 1 миллиона. Среди всех вариантов гиперхолестеринемии на долю семейной ГХС приходится 10% случаев.

Причины
СГХС является наследственной аутосомно-доминантной патологией, которая вызывается мутацией генов, ответственных за метаболизм ЛПНП и активность их рецепторов. При наличии одного дефектного гена в паре возникает гетерозиготная гиперхолестеринемия – легкое и умеренное нарушение метаболизма липидов. В редких случаях у пациентов присутствует два парных измененных гена (от матери и от отца), развивается гомозиготная гиперхолестеринемия – тяжелое расстройство липидного обмена со злокачественным течением. Причиной семейной гиперхолестеринемии является мутация в одном из следующих генов:
- LDLR. Ген задает функциональность ЛПНП-рецептора, расположенного, в основном, на поверхности клеток печени. При мутации его активность снижается, процесс связывания и выведения из кровотока циркулирующих липопротеидов нарушается. Выявлено более 1600 видов мутаций гена LDLR. Их доля в общем количестве СГХС составляет 85-90%.
- APOB. Дефект гена приводит к изменению структуры аполипопротеина B100, входящего в состав ЛПНП, обеспечивающего их связывание с рецептором. Мутационные изменения APOB имеются у 5-10% больных наследственной гиперхолестеринемией. Они провоцируют менее выраженное повышение ЛПНП, чем мутации LDLR.
- PCSK9. Этот ген кодирует фермент пропротеиновую конвертазу субтилизин-кексинового типа 9, которая усиливает разрушение ЛПНП-рецепторов. Мутации в гене PCSK9 увеличивают активность фермента, в результате чего количество рецепторов уменьшается. Патология такого типа встречается в 5% случаев СГХС.
Патогенез
В основе семейной гиперхолестеринемии лежит генетически обусловленное повышение уровня ЛПНП. Чаще всего оно вызывается снижением активности специфического рецептора, ответственного за выведение липопротеинов. ЛПНП – наиболее атерогенные частицы. Атеросклеротические бляшки формируются при их накоплении в субэндотелиальном пространстве. Чем выше уровень липопротеинов с низкой плотностью в крови, тем интенсивнее протекает процесс.
Хуже всего ЛПНП выводятся у людей с гомозиготной первичной гиперхолестеринемией: оба парных гена имеют мутацию, функциональность рецептора снижена на более чем на 50%, концентрация ЛПНП высокая, плохо поддается коррекции при помощи медикаментов и диеты. Атеросклероз и его осложнения развиваются в детском и подростковом возрасте. При гиперхолестеринемии гетерозиготного типа только один ген дефектный, половина или более рецепторов остаются функциональными, количество ЛПНП повышается, но долгое время не проявляется клинически. Зачастую первым признаком СГХС становится атеросклероз, ишемическая болезнь сердца или инфаркт миокарда.
Симптомы
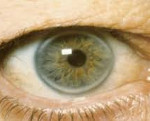
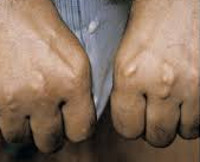
СГСХ развивается с рождения, но часто не имеет выраженных клинических признаков. Диагноз устанавливается с опозданием при манифестации сердечно-сосудистых заболеваний, таких как ИБС, инфаркт сердечной мышцы, атеросклероз. Симптомы гиперхолестеринемии наблюдаются менее чем у половины больных. Примерно у трети пациентов формируются сухожильные ксантомы – уплотнения из жироподобного вещества (холестерина), прощупываемые над сухожилиями. Узелки особенно легко определяются на кистях. Холестерин откладывается под кожей век, возле глаз в виде ксантелазм – желтоватых или не имеющих специфического цвета плоских узелков.
Патогномоничный признак СГСХ – липоидная дуга роговицы. Она представляет собой скопления холестерина по краю роговицы, которые обнаруживаются при офтальмологическом осмотре и выглядят как белый или серо-белый ободок. В отдельных случаях больные отмечают боль и дискомфорт в области груди, водянистые высыпания на коже рук, локтей и коленей. На стадии развития атеросклероза выявляются мозаичные симптомы поражения внутренних органов.
Осложнения
При отсутствии лечения гомозиготная первичная гиперхолестеринемия способствует развитию атеросклероза до 20-летнего возраста, продолжительность жизни больных не превышает 30 лет. Нелеченые пациенты с гетерозиготной формой патологии имеют высокий риск развития ИБС, к 60 годам диагноз подтверждается у 85,5% мужчин и у 53% женщин. Средние показатели продолжительности жизни для мужчин составляют 53 года, для женщин – 62 года. ИБС становится причиной смерти половины мужчин с наследственной гетерозиготной гиперхолестеринемией. Около 20% случаев инфаркта миокарда до 45 лет связаны с наличием СГХС.
Диагностика
Обследованием пациентов занимаются терапевт, кардиолог, врач-генетик. Важным этапом диагностики является сбор личного и семейного анамнеза. Учитывается возраст больного и время начала симптомов, потому что для наследственной патологии характерен ранний дебют. В пользу диагноза семейной гиперхолестеринемии рассматривается наличие двух и более близких родственников (особенно детей) с повышенным холестерином крови, ксантомами и/или липоидными дугами роговиц. Основная задача дифференциальной диагностики – исключение вторичной гиперхолестеринемии. Обследование больных проводится следующими методами:
- Физикальный осмотр. При тщательной пальпации сухожилий стоп, голеней и кистей обнаруживаются ксантомы. На роговице определяется наличие полной или частичной липоидной дуги, у лиц моложе 45-48 лет она указывает на СГХС. Отсутствие ксантом, ксантелазм и роговичной дуги не исключает наличия гиперхолестеринемии.
- Липидограмма. Комплексное лабораторное исследование липидного профиля является наиболее информативным методом диагностики. Показатель общего холестерина при гетерозиготной патологии составляет 7,5-14 ммоль/л, при гомозиготной – 14-26 ммоль/л. Уровень ЛПНП соответственно повышается до 3,3-4,9 ммоль/л и до 4,15-6,5 ммоль/л.
- Генетический скрининг. Выявление мутаций и их характера необходимо при невозможности подтвердить диагноз другими способами, а также для составления оптимального плана лечения. У 80% пациентов обнаруживаются дефекты в генах LDLR, APOB или PCSK9. У оставшихся 20% генетические изменения не диагностируются даже при развернутых симптомах СГХС.
Лечение семейной гиперхолестеринемии
Терапия включает комплекс мероприятий, нацеленных на снижение количества ЛПНП. Тактика определяется формой гиперхолестеринемии, величиной отклонения показателей липидограммы от нормы, выраженностью симптомов и возрастом пациента. Значительная часть лечебных процедур проводится амбулаторно при регулярном контроле эффективности лечащим врачом. Пациентам назначается:
- Медикаментозная терапия. Применяются препараты, понижающие уровень липидов в плазме крови. Наиболее целесообразен комбинированный прием статинов, фибратов, секвестрантов желчных кислот и ингибиторов абсорбции холестерина в кишечнике.
- Коррекция образа жизни. Исключаются все факторы риска гиперлипидемии: требуется полный отказ от курения, контроль артериального давления, нормализация массы тела, регулярная физическая нагрузка. Диетотерапия основана на ограничении количества насыщенных жиров и трансжиров. Ежедневное поступление холестерина с пищей – не более 200 мг.
- Аферез ЛПНП. При гомозиготном типе гиперхолестеринемии медикаментозное лечение зачастую оказывается недостаточно результативным. Проводятся процедуры удаления липопротеинов из крови. Аферез также может быть показан больным ИБС и атеросклерозом с СГХС гетерозиготной формы, особенно если прием лекарств не дает ожидаемого положительного эффекта.
- Стимуляция ЛПНП-рецепторов. С недавних пор в медицинскую практику внедряется патогенетическая терапия СГХС. Используется препарат, стимулирующий увеличение количества рецепторов ЛПНП в клетках печени. В итоге усиливается захват и выведение из организма липопротеинов.
Прогноз и профилактика
Благоприятное течение семейной гиперхолестеринемии наиболее вероятно при гетерозиготном типе, раннем начале лечения и периодическом контроле уровня холестерина на протяжении всей жизни. Из-за наследственного характера патологии предупредить ее развитие невозможно. Профилактические меры нацелены на раннюю диагностику гиперхолестеринемии, что позволяет сократить вероятность атеросклероза, ИБС, инфаркта мышцы сердца. Для этого проводится каскадный скрининг – исследование уровня липидов крови у всех ближайших родственников пациента.
Семейная гиперхолестеринемия: причины, симптомы и лечение

Чистая гиперхолестеринемия или семейная гиперхолестеринемия – это состояние, при котором у человека из-за генетической аномалии наблюдается повышенный уровень холестерина в крови.
В США данное нарушение встречается у 1 из 300-500 человек. Однако приблизительно 90% случаев семейной гиперхолестеринемии остаются недиагностированными.
Хотя высокий уровень холестерина часто является результатом употребления продуктов с высоким содержанием жиров, чистая гиперхолестеринемия не связана с образом жизни или диетой. Тем не менее, данное нарушение так же опасно для здоровья человека, поскольку может увеличить риск развития ишемической болезни сердца.
При чистой гиперхолестеринемии печень теряет способность перерабатывать холестерин и регулировать его уровень в крови. В результате содержание холестерина в организме увеличивается.
Существует две формы этого заболевания: гетерозиготная семейная гиперхолестеринемия (когда человек наследует чистую гиперхолестеринемию от одного родителя) и гомозиготная семейная гиперхолестеринемия (когда человек наследует данное нарушение от обоих родителей). Гомозиготная форма гиперхолестеринемии часто приводит к более тяжелым симптомам, чем гетерозиготная форма.
Факторы риска чистой гиперхолестеринемии
Основным фактором риска развития чистой гиперхолестеринемии является наличие данного нарушения в анамнезе у одного или обоих родителей.
Если один из родителей болеет чистой гиперхолестеринемией, существует 50-процентный шанс того, что его ребенок также унаследует это нарушение. Риску семейной гиперхолестеринемии более подвержены представители определенных этнических групп, например, евреи ашкенази, французские канадцы, ливанцы, южноафриканские африканеры.

Симптомы чистой гиперхолестеринемии
Семейная гиперхолестеринемия возникает с рождения, и, к сожалению, высокий уровень холестерина в крови на ранних стадиях часто не проявляется какими-то симптомами. Хотя проявления гиперхолестеринемии возникают редко, некоторые люди с данным нарушением могут испытывать следующие симптомы:
– Небольшие волдыри на коже, обычно на руках, локтях, коленях или вокруг глаз
– Ксантомы (отложения холестерина в коже или сухожилиях)
– Небольшие отложения холестерина желтого цвета под глазами или вокруг век
– У человека, унаследовавшего мутированные гены чистой гиперхолестеринемии от обоих родителей, имеет больше шансов на появление ксантом в раннем возрасте, даже в младенчестве.
Осложнения чистой гиперхолестеринемии
Люди нуждаются в холестерине для поддержания функции клеток и выработки гормонов. Тем не менее, избыток холестерина может быть очень вредным для здоровья человека. Избыточный холестерин может откладываться и накапливаться в артериях, что приводит к сужению их просвета и развитию ишемической болезни сердца. При разрушении атеросклеротических бляшек (отчасти образованных из холестерина) может закупориваться просвет артерии, вызывая сердечный приступ.
По данным Национального исследовательского института генома человека, у мужчин с семейной гиперхолестеринемией сердечные приступы возникают в возрасте от 40 до 50 лет. По оценкам, 85% мужчин с этим заболеванием будут иметь сердечный приступ до достижения 60-летнего возраста. Женщины с семейной гиперхолестеринемией также подвержены повышенному риску сердечного приступа, чаще всего в возрасте 50-60 лет.
Диагностика чистой гиперхолестеринемии
Врачи диагностируют семейную гиперхолестеринемию на основании симптомов, семейного анамнеза и результатов лабораторных анализов. Уровень общего холестерина выше 300 мг/дл (выше 250 мг/дл у детей) уже является поводом для беспокойства. Генетический анализ позволяет выявить генетическую мутацию в 19-й хромосоме, которая указывает на чистую гиперхолестеринемию.
Лечение чистой гиперхолестеринемии
Лечение семейной гиперхолестеринемии часто зависит от степени тяжести симптомов и повышения уровня холестерина в крови. Почти всем людям с этим заболеванием понадобится прием рецептурных лекарственных средств, которые снижают уровень общего холестерина. Самые распространенные лекарства – это статины.
Семейная гиперхолестеринемия – факторы наследования, симптомы и лечение
Этиология и встречаемость семейной гиперхолестеринемии. Семейная гиперхолестеринемия (MIM №143890) — аутосомно-доминантное заболевание метаболизма холестерина и липидов, вызываемое мутациями в гене LDLR. Семейная гиперхолестеринемия встречается во всех расах и имеет распространение 1 на 500 в большинстве европеоидных популяций. Это составляет чуть меньше 5% всех пациентов с гиперхолестеринемией.
Патогенез семейной гиперхолестеринемии
Рецептор ЛПНП, трансмембранный гликопротеид, преимущественно экспрессирующийся в печени и коре надпочечников, играет ключевую роль в гомеостазе холестерина. Он связывает аполипопротеин В-100, единственный белок ЛПНП, и АроЕ, белок ЛПОНП, липопротеинов средней плотности, остатков хиломикронов и некоторых ЛПВП. Рецепторы ЛПНП печени захватывают из кровотока приблизительно 50% липопротеинов промежуточной плотности и 66-80% низкой плотности за счет эндоцитоза; остаток захватывается недостаточно изученным путем, не зависящим от рецептора ЛПНП.
Мутации, связываемые с семейной гиперхолестеринемией, наблюдают в гене LDLR; от 2 до 10% таких мутаций — большие инсерции, делеции или перестройки, вызванные рекомбинацией между повторами Alu в пределах гена LDLR. Некоторые мутации — доминантные. Большинство мутаций достаточно редкие, хотя некоторые популяции — например, ливанцы, французские канадцы, южноафриканские индийцы, южноафриканские евреи ашкенази и африканеры (жители ЮАР голландского происхождения) имеют общие мутации и высокое распространение болезни из-за эффекта родоначальника.
Гомозиготные или гетерозиготные мутации в гене LDLR уменьшают эффективность эндоцитоза ЛПНП и липопротеинов средней плотности и вызывают накопление ЛПНП плазмы за счет увеличения их синтеза из липопротеинов средней плотности и уменьшения печеночного захвата. Высокий уровень ЛПНП в плазме вызывает атеросклероз, увеличивая захват ЛПНП через рецептор-независимые пути, например эндоцитоз окисленных ЛПНП макрофагами и гистиоцитами.
Моноциты, проникающие через интиму артерий и захватывающие ЛПНП, образуют пенистые клетки и выбрасывают цитокины, вызывающие пролиферацию гладкомышечных клеток артериальной стенки. Первоначально гладкомышечные клетки производят достаточно коллагена и матричного белка, чтобы сформировать над пенистыми клетками волокнистый колпачок; но, поскольку пенистые клетки продолжают эндоцитоз окисленных ЛПНП, в конечном счете, они прорываются через колпачок в просвет артерии и инициируют образование тромба. Такое образование тромба — основная причина инсультов и инфарктов миокарда.
Окружающая среда, пол и генетический фон модифицируют эффект мутаций рецептора ЛПНП на их уровень в плазме, и тем самым частоту возникновения атеросклероза. Основной средовой модификатор уровня ЛПНП в плазме — диета; в Тунисе большинство гетерозигот по семейной гиперхолестеринемии имеют уровень ЛПНП в диапазоне «нормы» для жителей США и редко страдают сердечно-сосудистыми болезнями и ксантомами.
Аналогично китайские гетерозиготы по семейной гиперхолестеринемии, проживая в Китае, редко имеют ксантомы и сердечно-сосудистую патологию, тогда как китайцы, гетерозиготы по семейной гиперхолестеринемии, проживающие в западных странах, имеют клинические проявления, сходные с гетерозиготами по семейной гиперхолестеринемии европейского происхождения. Пищевой холестерин подавляет синтез рецепторов ЛПНП и тем самым поднимает уровень ЛПНП в плазме; этот эффект усиливается насыщенными жирными кислотами, например пальмитиновой (из молочных продуктов), и ослабляется ненасыщенными жирными кислотой, например олеиновой и линолевой.
Поскольку аналогичная диета неодинаково поднимает уровень ЛПНП среди разных пациентов, на метаболизм ЛПНП также должны влиять и другие средовые и генетические факторы. Некоторые семьи с семейной гиперхолестеринемией передают другой доминантный локус, уменьшающий уровень ЛПНП в плазме, что подтверждает наличие генетического модификатора.

Фенотип и развитие семейной гиперхолестеринемии
Гиперхолестеринемия, самый ранний симптом при семейной гиперхолестеринемии, обычно появляется уже при рождении и остается единственным клиническим симптомом в первом десятилетии жизни у гетерозиготных пациентов; во всех возрастных периодах концентрация холестерина в плазме выше 95-го процентиля у более чем 95% пациентов. «Старческая» дуга роговицы и ксантомы сухожилий начинают появляться к концу второго десятилетия жизни, к моменту смерти уже 80% гетерозигот по семейной гиперхолестеринемии имеют ксантомы. Почти 40% взрослых пациентов имеют рецидивирующие непрогрессирующие полиартриты и тендосиновиты.
Подсчитано, что развитие ИБС среди гетерозигот по семейной гиперхолестеринемии зависит от возраста и пола. Чаще всего при отсутствии лечения концентрация холестерина превышает 300 мг/дл.
Гомозиготная форма семейной гиперхолестеринемии проявляется ксантомами сухожилий и дугой роговицы уже на первом десятилетии жизни. Без энергичного лечения гомозиготная семейная гиперхолестеринемия обычно летальна к возрасту 30 лет. Концентрация холестерина без лечения колеблется между 600 и 1000 мг/дл.
Особенности проявлений семейной гиперхолестеринемии:
• Возраст начала: для гетерозигот — молодость или средний возраст; для гомозигот — детство
• Гиперхолестеринемия
• Атеросклероз
• Ксантомы
• Старческая дуга
Лечение семейной гиперхолестеринемии
Повышение холестерина ЛПНП плазмы крови и наличие в семейном анамнезе гиперхолестеринемии, ксантом или ранней ИБС заставляет предположить диагноз семейной гиперхолестеринемии. Тем не менее подтвердить диагноз трудно, поскольку для этого нужно определить функции рецептора ЛПНП в фибробластах кожи или мутации в гене LDLR. В большинстве популяций большое количество мутаций в гене LDLR затрудняет прямой анализ ДНК, если не подозревается конкретная мутация.
Тем не менее отсутствие ДНК-подтверждения не создает помех для оказания помощи пациентам с семейной гиперхолестеринемией, поскольку окончательный молекулярный диагноз не дает прогностической или терапевтической информации, в основном зависящей от семейного анамнеза и уровня холестерина в плазме.
Независимо от того, семейная это гиперхолестеринемия или нет, все пациенты с повышенным уровнем холестерина ЛПНП требуют энергичных мер по нормализации концентрации для уменьшения риска ИБС. Тщательная нормализация уровня холестерина может предохранить и обратить развитие атеросклероза. Гетерозиготам по семейной гиперхолестеринемии необходимо строжайшее соблюдение высокоуглеводной диеты с резким уменьшением потребления жиров, обычно приводящей к 10-20% снижению уровня холестерина ЛПНП.
Поскольку такого уменьшения обычно недостаточно, пациентам также назначают лечение одним из трех классов лекAPCтвенных средств (или их комбинацией): секвестрантами желчных кислот, статинами (ингибиторы 3-гидрокси-3-метилглутарил КоА редуктазы) и никотиновой кислотой. Текущие рекомендации — начало лекарственной терапии в 10-летнем возрасте у пациентов с концентрацией холестерина ЛПНП выше 190 мг/дл и отрицательным семейным анамнезом по ранней ИБС, и для пациентов с уровнем холестерина ЛПНП выше 160 мг/ дл с положительным семейным анамнезом.
У гомозигот по семейной гиперхолестеринемии уровень холестерина плазмы можно уменьшить до 70% с помощью плазмафереза. Терапевтическая эффективность плазмафереза повышается, если его проводить на фоне энергичной терапии статинами и никотиновой кислотой. В редких случаях проводят пересадку печени.
Показатели зависимости ИБС и смерти от возраста и пола (в %) у гетерозигот по семейной гиперхолестеринемии 
Риски наследования семейной гиперхолестеринемии
Поскольку семейная гиперхолестеринемия — аутосомно-доминантное заболевание, каждый ребенок больного родителя имеет 50% шанс унаследовать мутантный аллель гена LDLR. Без лечения гетерозиготы по семейной гиперхолестеринемии имеют 100% риск развития ИБС к 70 годам для мужчин и 75% риска для женщин. Постоянное лечение заметно уменьшает этот риск, нормализуя концентрацию холестерина в плазме.
Пример семейной гиперхолестеринемии. У Л.Л., ранее здорового 45-летнего французского канадца, произошел инфаркт миокарда. У него была небольшая ксантома в ахилловом сухожилии справа. У его брата также была ИБС; его мать, бабушка по матери и два дяди по матери умерли от осложнений ИБС. Кроме семейного анамнеза и пола, факторы риска по ИБС и атеросклерозу для Л.Л. включали повышенный уровень ЛПНП, небольшое ожирение, малую физическую активность и курение. На основе семейного анамнеза заподозрена аутосомно-доминантная форма гиперхолестеринемии.
В подтверждение этого подозрения при молекулярном анализе обнаружено, что он гетерозиготен по делеции 5′-конца гена рецептора ЛПНП (LDLR), эту мутацию обнаруживают у 59% французских канадцев с семейной гиперхолестеринемией. Обследование детей Л.Л. показало, что у двоих из трех детей уровень ЛПНП повышен.
Кардиолог сказал Л.Л., что дополнительно к лекарственной терапии эффективное лечение его ИБС требует изменения диеты и образа жизни, т.е. снижения в рационе питания насыщенных жиров и холестерина, повышения физической активности, снижения массы тела и прекращения курения. Больной не последовал этим рекомендациям и умер годом позже от повторного инфаркта.
Источники:
http://sosudy.info/semejnaya-giperholesterinemiya
http://medbe.ru/news/meditsina/semeynaya-giperkholesterinemiya-simptomy-lechenie-i-rekomendatsii/
http://meduniver.com/Medical/genetika/semeinaia_giperxolesterinemia.html
http://www.krasotaimedicina.ru/diseases/genetic/familial-hypercholesterolemia
http://kardiomag.com/post/semeynaya-giperholesterinemiya-prichinyi-simptomyi-i-lechenie--101.html
http://meduniver.com/Medical/genetika/semeinaia_giperxolesterinemia.html



