Предимплантационная диагностика
Дополнительной процедурой к вспомогательным репродуктивным технологиям является преимплантационная генетическая диагностика эмбрионов – ПГД (PGD) или преимплантационное генетическое тестирование – ПГТ. Главное преимущество данного метода – отсутствие селективного прерывания беременности, а также высокая вероятность рождения ребёнка без диагностируемого генетического заболевания.
ПГД — это проверка эмбриона, полученного с использованием экстракорпорального оплодотворения (ЭКО) на наличие генетических аномалий до его имплантации в полость матки. В этом случае возможно отобрать здоровые эмбрионы еще до стадии переноса.
Настоящая технология применяется почти 30 лет, и с каждым годом ее востребованность растет вместе с увеличением количества женщин, желающих родить после 35 лет. Манипуляция выполняется только при ЭКО, не предоставляет угрозы для женщины и не влияет на будущую беременность. Во время естественного зачатия провести такое исследование невозможно, но как альтернативный метод проводят пренатальную диагностику.
Однако, при получении негативных результатов обследования – паре будет предложено прервать беременность. Преимплантационная диагностика наследственных болезней позволяет избежать этого, так как манипуляция предоставляет максимум информации о зародыше, что дает возможность отобрать самые качественные клетки.
Процедуру проводят не всем, только, когда известно, что родители либо болеют, либо носители моногенного заболевания. Таким образом, можно определить, унаследует ли ребенок хромосомные патологии от родителей или нет. У пар, страдающих бесплодием, проводят не тестирование, а скрининг, поэтому потребность в таком исследовании небольшая.
Обследование выполняется для исключения мутаций или несбалансированной хромосомной перестройки. Перенос недиагностированных бластоцист не проводится.
В настоящее время известно более 40 моногенных генетических заболеваний. Самые распространенные:
Типы ПГД
ПГС – преимплантационный генетический скрининг.
ПГТ – преимплантационное генетическое тестирование – то же самое, что и диагностика. Под диагностикой понимают анализ методом FISH по определенному числу хромосом, а под тестированием – методом CGH/NGS с диагностикой всех хромосомных пар.
Несколько типов ПГТ исследований:
ПГТ-А – анализ анеуплоидий выявляет лишние или недостающие хромосомы в клеточном ядре, то есть направлен на выбор бластоцист с нормальным количеством хромосом. Он позволяет быстрее получить желаемую беременность (повышает шансы до 70-75%) и избежать переноса анеуплоидов, например, с синдромом Дауна.
ПГТ-М – тестирование на наличие наследственных болезней. Диагностика проводится только на выявление конкретной патологии, поэтому необходима дополнительная диагностика родителей для уточнения, в каком участке гена могла произойти мутация. Данный тип исследования гарантирует отсутствие конкретного дефекта, но не дает гарантии на отсутствие других нарушений в геноме.
ПГТ – SR – тестирование на наличие специфических перестроек в их ДНК, которые так же могут приводить к разным заболеваниям и передаваться по наследству.
Чтобы определить, какой метод диагностики будет наиболее эффективным для вашей пары, нужно записаться на консультацию к генетику.
Показания к проведению
Преимплантационное обследование рекомендуется парам с рисками передачи известных хромосомных аномалий своим детям. Наличие показаний для осуществления ПГД первоначально определяет репродуктолог, а решение о целесообразности такого исследования принимает врач-генетик. Оно может быть проведено в протоколе экстракорпорального оплодотворения за свой счет. Противопоказаний к проведению нет.
- Пары с Х-сцепленными нарушениями (риск для ребёнка 25%, половина из них мужского пола);
- Пары с хромосомными транслокациями, которые могут вызвать отсутствие имплантации, невынашивания беременности, или психические или физические нарушения у детей;
- Носители аутосомно-рецессивных расстройств (риск для ребёнка составляет 25%);
- Носители аутосомно-доминантный расстройств (риск для ребёнка составляет 50%).
Примерами распространенных заболеваний могут служить:
- муковисцидоз,
- фенилкетонурия,
- болезнь Тэй-Сакса,
- болезнь Гоше,
- пигментный ретинит,
- серповидно-клеточная анемия,
- талассемия,
- анемия Фанкони,
- гемофилия,
- миодистрофия Дюшенна,
- миодистрофия Бейкера,
- пузырчатка,
- поликистоз почек,
- болезнь Альцгеймера,
- ретинобластома,
- семейный рак груди,
- семейный аденоматозный полипоз,
- семейный канцероидный синдром,
- нейрофиброматоз,
- гидроцефалия,
- хорея Гентингтона,
- синдром Х-ломкой хромосомы,
- спиноцеребральная атаксия.
Делать ли ПГД?
Преимплантационное тестирование может потребоваться в следующих случаях:
- Возраст партнеров – женщин от 35 лет, а мужчины от 40;
- Невынашивание беременности, повторные самопроизвольные аборты, замершие беременности;
- Неудачные попытки ЭКО (две и более) в анамнезе;
- Генетические отклонения были ранее выявлены у детей или у плода;
- Причины мужского бесплодия;
- Тяжёлые нарушения сперматогенеза;
- Наличие у родителей наследственных болезней, имеющих половую принадлежность;
- Присутствие высокого риска рождения ребенка с моногенным заболеванием (например, с муковисцидозом, спинальной мышечной атрофией, фенилкетонурией и другими патологиями);
- Возможность резус-конфликта между матерью и будущим ребенком.
По желанию пар можно сделать ПГД эмбриона на:
- Определения пола
- Тестирования на совместимость по человеческим лейкоцитарным антигенам (HLA)
- Исключения болезней с поздним проявлением (болезнь Альцгеймера, РМЖ)
- Исключения болезней, не угрожающих жизни
- Тестирования наследственных предрасположенностей
Супружеские пары, которые не могут забеременеть естественным путем, получают консультацию генетика. Специалист при необходимости назначает анализы с целью определения кариотипа и дает индивидуальные рекомендации относительно необходимости проведения ПГД перед переносом.
ПГД эмбриона цена
Биопсия
Криоконсервация, витрификация, хранение
Генетика
ПГТ моногенного заболевания 1 категории сложности, включая подготовительный этап (заболевания, для которых разработаны элементы тест-системы).
ПГТ моногенного заболевания 1 категории сложности, включая подготовительный этап (заболевания, для которых разработаны элементы тест-системы)
Комбинированный тест ENDOMETRIO определение уровня рецептивности (тест ERA, микробиоты (тест EMMA) и патогенной микрофлоры эндометрия (тестАLICE)
Техника проведения манипуляции
Предимплантационное обследование рекомендуется парам с рисками передачи известных хромосомных аномалий своим детям. Наличие показаний для осуществления ПГД первоначально определяет репродуктолог, а решение о целесообразности такого исследования принимает врач-генетик. Оно может быть проведено в протоколе экстракорпорального оплодотворения за свой счет. Противопоказаний к проведению нет.
С чего начинается ПГД?
Подготовка к лечебному циклу ЭКО с ПГД практически не отличается от обычного лечебного цикла ЭКО:
- женщина принимает гормональные препараты для стимуляции суперовуляции;
- производится забор фолликулов с помощью пункции через влагалище;
- в условиях эмбриологической лаборатории проводится оплодотворение (ЭКО/ИКСИ) яйцеклеток сперматозоидами;
- культивирование в специальных условиях;
- тщательный отбор, отдается предпочтение нормально делящимся и морфологически полноценным зародышам;
- лабораторная биопсия трофэктодермы на 5-6 день культивирования (с помощью механического или лазерного метода), фиксация бластомера. Ранее ПГД проводилось на 3 день культивирования, однако проведение биопсии на этом этапе заметно снижает жизнеспособность эмбрионов. В то же время забор клеток на 5 день после оплодотворения не влияет на их дальнейшее развитие.
- криоконсервация после биопсии трофэктодермы;
- генетический тест зафиксированных клеток и получение результатов;
- эмбриотрансфер в полость матки эмбрионов без генетических дефектов;
- через две недели стандартная процедура диагностики беременности.
Сопутствующие риски и результаты исследования зависят от навыков и квалификации эмбриолога, проводящего биопсию. Такая процедура относится к высокотехнологичным и дорогим исследованиям. Поэтому предпочтительно сразу обращаться в крупные специализированные центры с возможностью проведения цитогенетического тестирования.
Результаты
По прошествии двух суток специалисты оценивают результаты и сопоставляют их с развитием соответствующего зародыша.
Если у него обнаружены отклонения, это означает обязательный отказ от переноса. В полость матки переносятся только те эмбрионы, у которых не было обнаружено патологий. Если исследование проводилось с цель рождения ребенка определенного пола (только по показаниям) или для предотвращения резус-конфликта, то подсаживаются соответствующие эмбрионы.
Схема ПГД применяется для конкретного случая своя. Если нарушение наследуется от женщины, то можно тестировать только полярные тельца. Можно также тестировать только бластомеры. Либо может проводиться последовательное изучение полярных телец, затем бластоцист. Какая именно схема будет применяться, определяется на консультации с врачом-генетиком.
Трофэктодерма: что это такое
В настоящее время предпочитают проводить биопсию трофэктодермы, а не забирать образцы еще не дифференцированной эмбриональной ткани. Такой подход позволяет увеличить жизнеспособность зародышей и минимизировать вред от манипуляции PGD.
Развитие эмбриона происходит по определенным закономерностям. После оплодотворения образуется зигота, которая начинает активно делиться, и количество зародышевых клеток растет в геометрической прогрессии. Продолжительность этого этапа до 3–4 суток. Затем происходит разделение клеток на 2 порции: наружную и внутреннюю. В толще эмбриональной клеточной массы формируется эксцентричная внутренняя полость – бластоцель, а достигшие этого этапа называются бластомерами. Трофэктодерма – наружный слой бластомера. Она является предшественником внезародышевых тканей, необходимых для нормальной имплантации эмбриона и последующего формирования плаценты. А внутренняя клеточная масса бластомера дает начало самому зародышу.
Внешний и внутренний листки бластоцисты имеют практически идентичный генный и хромосомный состав, поэтому информативность анализа трофэктодермы такая же высокая, как и при исследовании на более ранних этапах развития зародыша.
На какой день выполняют диагностику
На этапе подготовке к ЭКО у пар часто возникают вопросы: сколько делается ПГД и когда следует эмбриоперенос. Во многих клиниках, преимплантационная генетическая диагностика эмбрионов выполняется на 3 сутки. После оплодотворения яйцеклеток сперматозоидами в условиях эмбриологической лаборатории эмбрион развивается — клетки делятся. На третий день количество клеток достигает 6-8, что позволяет провести генетический анализ эмбриона без ущерба для дальнейшего развития зародыша.
В этот день происходит биопсия, то есть извлечение одного бластомера с помощью специальных микроинструментов. При стандартном протоколе без криоконсервации исследование выполняется за короткое время, так как эмбрион не может продолжать развиваться вне организма матери далее стадии бластоцисты (5-е сутки после оплодотворения). Пока выполняется генетическая диагностика, эмбрионы продолжают развиваться в соответствующей культуральной среде, после чего переносятся в полость матки на 5-е сутки развития. К этому времени эмбрион достигает стадии бластоцисты. Альтернативный подход – анализ ПГД в криоцикле. В этом случае биопсия производится на 5 день развития, а затем они подвергаются криоконсервации. Если в протоколе без верификации у эмбриологов остается не больше 48 часов для анализа, то в криоцикле специалист в течение месяца проводит генетическую диагностику.
Практика разобщённого цикла по сравнению со стандартным протоколом без криконсервации характеризуется: меньшим риском гиперстимуляции, большим количеством материала и временем для анализа, а также менее травматичной для эмбриона процедурой биопсии. В зависимости от вида протокола ЭКО специалисты индивидуально выбирают сроки проведения ПГС.
Используемые методы ПГД
У каждого метода свои преимущества и недостатки. Основные различия связаны с хромосомным числом, точностью результата и ценой процедуры.
Вспомогательные технологии при проведении ЭКО (пренатальный генетический скринингдиагностика)
Процедура, которая позволяет проводить исследования на мутации в последовательности определенных генов или анеуплоидий перед процедурой подсадки нормального по исследуемым хромосомам эмбриона в матку. Для этого при проведении программы ЭКО, как правило, на 5-е сутки культивирования эмбрионов извлекают 3-5 клеток, для проведения исследования на мутации в последовательности определенных генов или анеуплоидий перед процедурой подсадки эмбриона в матку.

Можно выделить два типа ПГТ
- Предимплантационная генетическая диагностика (ПГД)
- Предимплантационный генетический скрининг (ПГС)
Предимплантационная генетическая диагностика (ПГД)
Проводится когда один или оба генетических родителя несут генную мутацию или сбалансированную хромосомную перестройку. Тестирование выполняется для исключения мутации или несбалансированной хромосомной перестройки у ооцита или эмбриона.
Целью проведения является идентификация генетически нормального эмбриона у пар высокого риска. Его подсадка для получения здорового ребенка
В данном случае ПГД проводится для диагностики и исключения конкретного заболевания
Не проводится перенос не диагностированных эмбрионов.
Данный тип диагностики проводится при наличии у родителей аутосомно – доминантных заболеваний (50%-ый риск наследования), аутосомно – рецессивные заболевания (25%-ый риск наследования), у женщин – носителей Х-сцепленных заболеваний (25 % половых клеток – половина мужских эмбрионов, носителей мутаций наследственных заболеваний, носители сбалансированных хромосомных перестроек (инверсий , транслокаций и т.д.)
В настоящее время разработаны методы диагностики более 40 различных моногенных генетических заболеваний. Наиболее распространенные из них:
1. Муковисцидоз.
2. Спинальная мышечная атрофия.
3. Нейросенсорная тугоухость.
4. Фенилкетонурия.
5. Адреногенитальный синдром.
6. Синдром Мартина-Белл (ломкая Х хромосома)
7. Бета-Галактоземия.
Возможна диагностика любой другой наследственной патологии, если известен ген и найдена мутация, приводящая к данному заболеванию.
Предимплантационный генетический скрининг (ПГС)
Целью проведения является выбор эмбриона для переноса с учетом его хромосомного статуса. В данной ситуации не диагностированные эмбрионы могут быть перенесены.
Показания для проведения ПГС.
- Возраст женщины
- Невынашивание беременности в анамнезе
- Регулярные потери ЭКО
- Тяжелое бесплодие мужчины
Также по желанию родителей можно сделать ПГС для
- Определения пола
- HLA-типирования
- Исключения заболеваний с поздним проявлением (болезнь Альцгеймера, РМЖ)
- Исключения заболеваний, не угрожающие жизни
- Тестирования наследственных предрасположенностей
Для хромосомного анализа разработано множество методов, суть которых в широком смысле – изучение структуры и функции хромосом в клетках практически любых тканей и органов, на любой стадии клеточного цикла, в митозе и мейозе.
Выбор цитогенетического метода определяется конкретной целью исследования, однако, в любом случае он состоит из двух этапов – получения и окраски хромосомных препаратов и собственно анализа хромосомного набора
Хромосомные болезни (Хромосомные синдромы)
Врожденная наследственная патология, обусловленная численными или структурными аномалиями кариотипа (геномными или хромосомными мутациями соответственно).
Как правило, фенотипическим проявлением хромосомных болезней являются множественные пороки развития (МВПР).
Этиология хромосомных болезней
геномные мутации (возникают de novo в гаметогенезе, реже – в первых делениях дробления зиготы)
– несбалансированные хромосомные мутации (обычно наследуются от родителей-носителей сбалансированных хромосомных перестроек; реже возникают de novo в гаметогенезе; совсем редко – в первых делениях дробления зиготы)
Методы предимплантационного генетического тестирования
- Многоцветная FISH на интерфазных ядрах доимплантационных эмбрионов
- Методы на основе ПЦР позволяют увеличить количество геномного сегмента, который содержит определенный ген для его дальнейшего анализа
В настоящее время появились новейщие технологии предимплантационного генетического тестирования, позволяющие диагностировать большее число заболеваний. Данные методики могут применяться как для предимплантационной генетической диагностики, так и для предимплантационного генетического тестирования
- CGH на микрочипах – возможность проводить диагностику по 24 хромосомам.
ПРЕИМУЩЕСТВА предимплантационного генетического тестирования:
- Выбор и перенос в матку только тех эмбрионов, которые не имеют хромосомных патологий
- Снижение риска рождения ребенка с определенными генетическими дефектами
- Снижение риска невынашивания беременности
- Снижение риска многоплодной беременности
- Увеличение шанса на успешную имплантацию
- Увеличение шансов на благополучное рождение ребенка
РИСК при проведении предимплантационного генетического тестирования:
- Риск случайного повреждения эмбриона ( <1%)
- Ошибочная диагностика (до 10%)
- 3,5% вероятности того, что эмбрион с патологией будет диагностирован как нормальный
- 10% вероятности того, что здоровый эмбрион будет диагностирован как эмбрион с патологией
- Отмена переноса эмбрионов из-за того, что по результатам ПГТ во всех эмбрионах будет обнаружена патология (до 20%)
ОПИСАНИЕ ПРОЦЕДУРЫ ПГД:
- Процедура ЭКО/ИКСИ до 5-го дня культивирования эмбрионов in vitro;
- Лабораторная процедура биопсии эмбриона на 5 день культивирования (с помощью механического или лазерного метода), а затем фиксация бластомера;
- Криоконсервация эмбрионов после проведения биопсии трофэктодермы;
- Генетическая диагностика зафиксированных клеток эмбриона и получение результатов диагностики;
- Подготовка пацитки к переносу размороженных эмбрионов;
- Перенос в полость матки эмбрионов без генетических дефектов на стадии бластоцисты;
- Стандартная процедура диагностики беременности примерно через две недели после переноса эмбрионов.
В ходе беременности рекомендуется проведение диагностических исследований, позволяющих определить, нормально ли развивается плод. Диагностика ряда патологий возможна с помощью амниоцентеза или биопсии ворсин хориона (забор клеток жидкости или тканей, окружающих эмбрион). Исследование амниотической жидкости и ультразвуковое исследование могут обнаружить определенные патологии центральной нервной системы плода или других органов. Вам необходимо обсудить возможность проведения этих исследований со своим акушером-гинекологом, наблюдающим беременность.
Как и в случае естественного зачатия, при проведении ЭКО не существует гарантии того, что не родится ребенок с невыявленными физическими или психическими отклонениями. Имеющиеся на сегодняшний день данные указывают на то, что риск развития патологий у детей после экстракорпорального оплодотворения (ЭКО) не выше такого риска после естественного зачатия.
ПГД эмбриона при ЭКО – что это значит?
ПГД эмбриона – это процедура, которая используется при проведении протокола экстракорпорального оплодотворения. Манипуляция позволяет получить максимум информации об эмбрионе, что дает возможность отобрать самые качественные клетки для переноса. Предимплантационная генетическая диагностика выполняется по показаниям и чаще назначается возрастным парам, но также может проводиться по желанию партнеров.
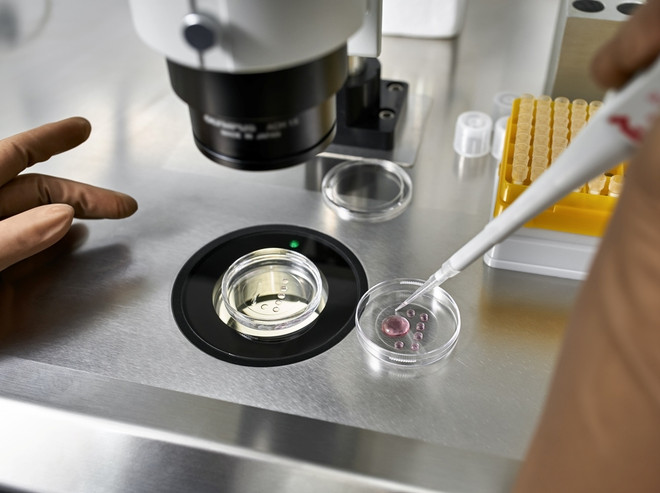
Что это такое
Предимплантационное генетическое обследование является способом обследования клеток эмбриона до переноса их в полость матки. Манипуляция не требует каких-либо усилий со стороны партнеров и осуществляется эмбриологами. Для будущих родителей, использующих методы ВРТ, разница в проведении протокола ЭКО с ПГД и без нее отсутствует.
Исследование генетических нарушений эмбриона – это манипуляция, с помощью которой специалисты могут предвидеть нарушения и прогнозировать результат переноса клеток. Данная процедура дает возможность определить, унаследует ли ребенок хромосомные патологии от родителей. Также диагностика позволяет выбрать эмбрион с определенным генетическим набором, что часто требуется при необходимости донации.
Предимплантационное обследование не представляет угрозы для будущей беременности и не способно навредить эмбриону. Сложно переоценить достоинства данной процедуры, поскольку она в разы снижает риск рождения детей с отклонениями.
Изучение генетического строения выполняется только при ЭКО. Во время естественного зачатия провести данную процедуру невозможно. Альтернативным способом обследования является пренатальная диагностика. Однако при получении негативных показателей дородового обследования паре будет предложено сделать прерывание. ПГД позволяет избежать таких проблем и при выявлении генетических нарушений у плода отказаться от его переноса.
Делать ли ПГД эмбриона
Предимплантационное обследование может быть проведено по желанию пары в протоколе экстракорпорального оплодотворения за свой счет.
Показания для выполнения ПГД:
- рождение в прошлом ребенка, который имеет генетические отклонения;
- наличие у родителей генетических заболеваний, которые имеют половую принадлежность;
- возраст партнеров – женщин от 35 лет, а мужчины от 40;
- неудачные попытки проведения ЭКО в анамнезе;
- привычное невынашивание беременности, самопроизвольное прерывание на одинаковом сроке;
- серьезные патологии спермы у мужчины, морфологические изменения в большинстве клеток;
- риск резус-конфликта между матерью и будущим ребенком.
Пары, которые не могут забеременеть естественным путем, в обязательном порядке получают консультацию генетика на этапе подготовки к использованию ВРТ. Специалист при необходимости назначает анализы с целью определения кариотипа и дает индивидуальные рекомендации относительно необходимости проведения ПГД эмбриона перед переносом.
На какой день выполняют диагностику
В большинстве медицинских учреждений, специализирующихся на использовании вспомогательных репродуктивных технологий, предимплантационное обследование выполняется на 3 сутки. К этому времени количество клеток эмбриона достигает 8, что позволяет без ущерба для дальнейшего развития провести анализ. Некоторые клиники предпочитают выполнять исследование на 5 день, когда количество клеток превышает 100. Такой метод считается более точным, однако не дает достаточно времени для проведения расширенного анализа.
В зависимости от вида протокола ЭКО специалисты индивидуально выбирают сроки проведения ПГД. Если предполагается криопротокол, то лучше выполнить биопсию на 5 сутки. В этом случае перенос эмбрионов планируют не ранее следующего цикла, что позволяет получить детальную информацию о генетическом материале и выбрать самые качественные клетки. Если протокол ЭКО не предполагает витрификации эмбрионов, то стоит сделать биопсию на 3 сутки развития зародыша.
У партнеров на этапе подготовке к экстракорпоральному оплодотворению часто возникают вопросы по поводу того, сколько делается ПГД и когда следуют перенос клеток. При стандартном протоколе без криоконсервации исследование проводится в сжатые сроки. Перенос эмбриона должен быть выполнен не позднее 5 дней его развития. Если биопсию взяли на 3 сутки, то у эмбриологов остается не больше 48 часов для генетического анализа.
Техника проведения манипуляции
Для партнеров, вступивших в протокол ЭКО, методика проведения процедуры с генетическим исследованием или без него не имеет существенных отличий. На начальном этапе женщина принимает гормональные средства для стимуляции, после чего выполняется забор ооцитов с помощью пункции через влагалище. Мужчина в это время сдает сперму, необходимую для оплодотворения эмбрионов. Для повышения качества клеток рекомендуется выполнить интрацитоплазматическую инъекцию, если у мужчины недостаточно хорошие показатели семенной жидкости.
После оплодотворения яйцеклетки сперматозоидом полученный материал выращивается в специальных условиях. Для проведения биопсии берется один эмбрион и помещается в чашу. С помощью миниатюрных инструментов под контролем оптической системы выполняется повреждение его оболочки лазерным лучом. Затем пипеткой берется необходимое количество клеток – обычно 1 или 2.
На следующем этапе специалисты проводят генетическое исследование полученного материала. В это время эмбрион продолжает развиваться в искусственных условиях, напоминающих полость матки. Полученным клеткам присваиваются цифирные значения в соответствии с нумерацией эмбрионов. Поэтому любые ошибки в результатах проведенных манипуляций исключены.
Результаты анализа
По прошествии двух суток специалисты оценивают полученные результаты и сопоставляют их с развитием соответствующего эмбриона. На сегодняшний день используются 3 методики предимплантационного исследования эмбрионов. Способ проведения анализа выбирается индивидуально и зависит от исходных показаний.
В полость матки женщины переносятся только те эмбрионы, у которых в процессе обследования не было обнаружено хромосомных поломок. Если процедура выполнялась с целью рождения ребенка определенного пола, то подсаживаются соответствующие клетки. Когда ПГД делают для предотвращения резус-конфликта, осуществляется перенос клеток с нужным показателем крови. Важным моментом при выборе клеток является оценка их развития на момент получения результата исследования.
Преимущество ПГД заключается в следующем:
- повышает вероятность успешного результата протокола;
- снижает риск самопроизвольного прерывания беременности на ранних сроках;
- позволяет избежать многоплодной беременности;
- практически исключает рождение ребенка с генетическими патологиями.
Эмбриологи уверены, что лучше выполнять ПГД с последующей витрификацией клеток. Это позволяет сделать доскональный анализ. Последующий перенос выполняется в естественном цикле, что значительно снижает нагрузку на организм женщины и создает условия, максимально близкие к естественному оплодотворению.
Преимплантационный генетический анализ эмбрионов
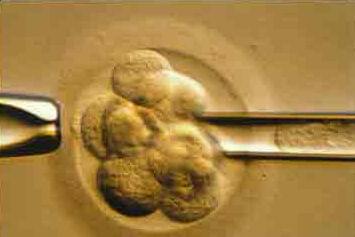
Каждая из 100 триллионов клеток в организме человека (за исключением красных кровяных клеток) содержит весь человеческий геном. Хромосомы – это струноподобные элементы внутри ядра (в центре) каждой клетки вашего тела. Они содержат генетическую информацию, ДНК. Ген занимает определенное место на хромосоме. В норме, есть 23 идентичных пары хромосом (2 метра ДНК) в каждой клетке, в общей сложности 46 хромосом. Каждый партнер во время оплодотворения обычно предоставляет 23 хромосомы. Если яйцеклетка или сперматозоид имеют аномальную упаковку хромосом, эмбрион, который они создают, также будет иметь хромосомные аномалии. Иногда это связано с перестройкой хромосом, или недостатком части хромосомы. В некоторых случаях есть отсутствующие хромосомы, или дополнительная хромосома (анеуплоидии), ведущие к наследственным заболеваниям. Любой эмбрион, в котором отсутствует хромосома (моносомия) перестанет расти до имплантации (фатальная аномалия). Если анеуплоидии включают хромосомы 13, 18, 21, Х или Y, беременность может дойти до родов. Наиболее распространенной из этих несмертельных аномалий является трисомия 21, или синдром Дауна, при которой присутствует дополнительная 21-я хромосома. Другие включают синдром Тернера у женщин и синдром Клайнфельтера у мужчин.
История преимплантационной генетической диагностики (ПГД)
Первые живорождения после ПГД были зарегистрированы в Лондоне в 1989 году. Две двойни девочек-близнецов родились от пяти пар с риском передачи связанного с Х-хромосомой заболевания. В настоящее время с помощью методов генетического анализа или ПГД могут быть обнаружены около 90% аномальных эмбрионов. Не все хромосомные или генетические заболевания могут быть определены этими процедурами, так как в ходе одной процедуры может быть диагностировано только ограниченное число хромосом. Многочисленные исследования на животных и некоторые исследования на человеке показывают, что микрохирургия эмбриона (биопсия), необходимая для удаления клеток, не влияет на нормальное развитие ребенка. Эта процедура, однако, была выполнена относительно небольшому числу пациентов во всем мире, поэтому точные негативные последствия, если таковые имеются, неизвестны. Несмотря на то, что после генетического анализа для выявления анеуплоидии всем мире на сегодняшний день было рождено уже много детей, эта процедура все еще относительно нова. В исследованиях на животных не было обнаружено никаких очевидных проблем и предварительные данные с эмбрионами человека позволяют предположить справедливость этого вывода. В исследовании, проведенном в Университетском колледже Лондона, исследователи недавно рассмотрели 12 преимплантационных эмбрионов с новой техникой, которая сочетает в себе амплификацию всего генома (WGA) и сравнительную гибридизацию генома (CGH). В результате в 8 из 12 изученных эмбрионов были обнаружены значительные хромосомные аномалии. Это может объяснить, почему люди имеют в лучшем случае 25% шансов на достижение жизнеспособной беременности в месяц при естественном зачатии.
Как передаются по наследству генетические заболевания
В диаграммах ниже, D или d представляет дефектный ген, а N или n представляет нормальный ген. Мутации не всегда приводят к болезни.
Доминантные заболевания:
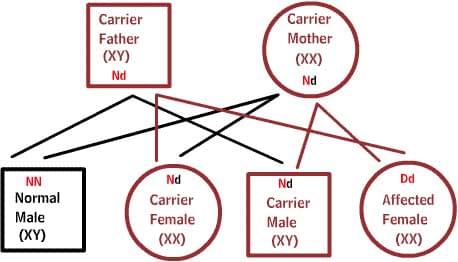
Один из родителей имеет один дефектный ген, который доминирует над своей нормальной парой. Так как потомки наследуют половину своего генетического материала от каждого из родителей, есть 50% риск наследования дефектного гена, и, следовательно, заболевания.
Рецессивные заболевания:
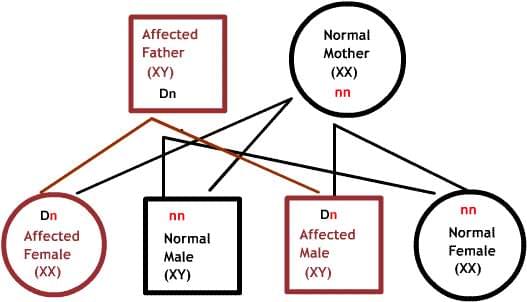
Оба родителя являются носителями одного дефектного гена, но при этом имеют нормальную пару гена. Для наследования заболевания необходимы две дефектных копии гена. Каждый потомок имеет 50% шанс быть носителем, и 25% шанс унаследовать заболевание.
X-сцепленные заболевания:
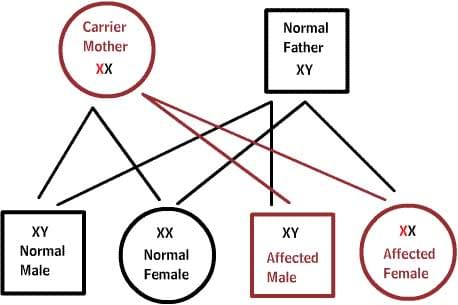
Нормальные женщины имеют XX хромосомы, а нормальные мужчины XY. Женщины, которые имеют нормальный ген на одной из Х-хромосом, защищены от дефектного гена на их другой Х-хромосоме. Однако, у мужчины отсутствует такая защита в связи с наличием только одной Х-хромосомы. Каждый мужской потомок от матери, которая несет в себе дефект, имеет 50% шанс унаследовать дефектный ген и заболевание. Каждый женский потомок имеет 50% шанс быть носителем, как и ее мать. (на рисунке ниже X представляет нормальный ген а X представляет дефектный ген)
Возможные преимущества генетического анализа
Преимплантационная генетическая диагностика позволяет отобрать и перенести не измененные (хромосомно нормальные) эмбрионы, которые могут привести к большей частоте имплантации на эмбрион, сокращению потерь беременности и рождению большего числа здоровых детей. Генетическая диагностика предлагает парам альтернативу мучительному выбору по поводу того, чтобы прервать пострадавшую беременность после пренатальной диагностики, производимой путем амниоцентеза или биопсии ворсин хориона (CVS) на более поздних стадиях беременности. Почти все генетически связанные заболевания, которые могут быть диагностированы в перинатальном периоде либо амниоцентезом или CVS, могут быть обнаружены и ПГД. Процедура должна уменьшить психологическую травму для пар, которые несут повышенный риск генетических заболеваний для потомства.
Преимущества преимплантационной генетической диагностики (ПГД) могут включать в себя:
- Была выдвинута гипотеза, что негативный отбор анеуплоидных эмбрионов позволит улучшить частоту имплантации, из-за корреляции между старшим возрастом матери и хромосомно аномальными эмбрионами. Хромосомно нормальные эмбрионы имеют в перспективе более высокие шансы на развитие. При переносе только хромосомно нормальных эмбрионов в матку, ваши шансы на невынашивание могут уменьшиться, а ваши шансы забеременеть могут увеличиться. Двадцать один процент спонтанных абортов обусловлены численными хромосомными нарушениями, и основным фактором риска является возраст матери. Трисомии увеличиваются с 2% у женщин 25 лет до 19% у женщин старше 40 лет. По данным ASRM-SART, 52% циклов ЭКО в США осуществляется для женщин 35 лет и старше, что показывает, что популяция ЭКО может получить большую пользу от скрининга хромосомных анеуплоидий. Важно отметить, что вероятность наступления беременности и родов здоровым ребенком, однако, снижается у пациентов старше 34 лет (как правило, менее 50%) из-за проблем, связанных с процедурой ЭКО.
- ПГД в состоянии идентифицировать большинство хромосомных аномалий с риском развития до родов. В настоящее время применяется ПГД хромосомных аномалии для X, Y, 13, 14, 15, 16, 18, 21 и 22 хромосом. Это составляет 70% анеуплоидий, обнаруживаемых при спонтанных абортах.
- Вполне возможно, что некоторая информация о ваших собственных яйцеклетках и эмбрионах может быть полезной для вас в случае дальнейших попыток ЭКО, или поможет объяснить прошлые неудачи при естественном зачатии или ЭКО.
- Будущие пациенты могут извлечь выгоду из информации, полученной от ПГД о связи между хромосомами, неразвивающимися или неимплантирующимися эмбрионами.
Возможные риски генетического анализа
- В лучшем случае, с помощью методов ПГД могут быть обнаружены около 90% от аномальных эмбрионов.
- Относительно большое число яйцеклеток или эмбрионов могут быть признаны ненормальными и поэтому для переноса останется только несколько эмбрионов. В некоторых случаях (11%), может не быть нормальных яйцеклеток или эмбрионов. В этих случаях перенос эмбриона не рекомендуется. Хотя это и разочаровывающий результат, вполне вероятно, что цикл ЭКО без ПГД не привел бы к беременности или привел бы к аномалиям у плода.
- Клетки, которые будут удалены, изучаются с помощью специализированных новых методов. Такие процедуры иногда не могут быть проведены из-за технических сложностей.
- Не все хромосомные или генетические отклонения могут быть определены пир помощи данных методов, так как в ходе одной процедуры может быть диагностировано только ограниченное число хромосом.
- Вполне возможно, что нормальный эмбрион может быть неправильно определен как ненормальный, и не перенесен, или что аномальный эмбрион неправильно определен как нормальный и будет перенесен в матку. (ПГД в настоящее время не является заменой для пренатальной диагностики. Рекомендуется проведение пренатальной диагностики для подтвердения диагноза).
- При удалении клеток может случайно произойти повреждение эмбриона (0,1%).
- Неявные технические обстоятельства в лаборатории могут привести к неудаче процесса тестирования, что приводит к отсутствию результатов. Неудача процесса тестирования не оказывает никакого влияния на ваш эмбрион. В этом случае, эмбрионы для переноса будут отобраны на основе существующих критериев.
- Анализ одной клетки имеет свои ограничения. Иногда, хромосомные аномалии находятся в одной клетке, но не в других клетках того же эмбриона, или наоборот, что выражается мозаицизмом. Это может привести к переносу аномального эмбриона, или к отказу от нормального эмбриона.
- ПГД для определения транслокаций может определить наличие или отсутствие определенных хромосомных нарушений, но не может ни определить генетическое заболевание, ни предсказать генетические уродства.
- Даже после успешной процедуры ПГД беременность может не наступить.
Кандидаты для биопсии эмбриона и ПГД
Кандидаты для биопсии эмбриона и ПГД включают в себя:
- Женщины старше 34 лет: женщины рождаются со всеми яйцеклетками, которые они будут когда-нибудь иметь, и по мере старения женщины ее яйцеклетки подвергаются также воздействию этого процесса старения. Таким образом, вероятность зачатия хромосомно аномального потомство с возрастом увеличивается. В целом риск анеуплоидии увеличивается с 1 на 385 в возрасте 30 лет, до 1 на 179 в возрасте 35 лет, до 1 на 63 в возрасте 40 лет, и в возрасте до 45 лет возможность рождения больного ребенка составляет 1 к 19. В результате использования ПГД при ЭКО стало известно, что в действительности больее чем 20% эмбрионов у женщин в возрасте от 35 до 39 анеуплоидны, и страдают почти 40% эмбрионов у женщин старше 40 лет. Большинство из этих эмбрионов в случае переноса в матку либо не имплантируются или приводят к невынашиванию. Это считается основной причиной низкой частоты наступления беременности и родов женщин в возрасте 40 лет и старше. До внедрения ПГД, для увеличения шансов на зачатие в матку переносилось большее число эмбрионов. По-прежнему настоятельно рекомендуется проведение пренатальной диагностики после цикла ЭКО, поскольку это подтверждает прогноз нормального потомства. Возможно также, что аномальные эмбрионы могут быть ошибочно определены как нормальные и перенесены в матку.
- Женщины с рецидивирующей потерей беременности (привычным невынашиванием): мужчина или женщина пары может иметь ненормальную упаковку хромосом, что может вызвать фатальные аномалии в некоторых беременностях, но не в других.
- Пары с транслокациями: транслокации – это изменения в конфигурации хромосом, при которых хромосомы прикрепляются друг к другу (робертсоновские) или участки разных хромосомах меняются местами (взаимные или реципрокные). Примерно 1 из 900 человек имеет робертсоновские транслокации с участием хромосом 13, 14, 15, 21, 22. Примерно 1 из 625 человек имеет взаимные транслокации. Для выявления наличия транслокаций может быть проведено кариотипирование обоих партнеров. Пары с транслокациями могут иметь периодические потери беременности, или потомство с психическими или физическими проблемами. При сбалансированной транслокации, когда нет дополнительного или отсутствия хромосомного материала, и разрыв в хромосоме не нарушает функции генов, человек не страдает. Носители сбалансированных транслокаций могут быть затронуты сложными врожденными пороками развития, которые могут или не могут быть связаны с наследственным заболеванием. При несбалансированной транслокации, при которой существует или отсутствует дополнительный материал хромосом, отдельные личности, как правило, не будут затронуты, хотя у некоторых будет наблюдаться снижение фертильности. Однако существует риск того, что яйцеклетки или сперматозоиды от такого человека могут иметь несбалансированные транслокации, в результате чего эмбрион будет несбалансированным. Это может привести к неудаче имплантации, повторному невынашиванию, или потомству с психическими или физическими проблемами.
- Пары с аутосомно-доминантными заболеваниями, при которых будут затронуты 50% эмбрионов. Пары, которые имеют данные нарушения в семейном анамнезе, или являются носителями, или страдают от наследуемых заболеваний.
Пары с повторными неудачами ЭКО.
- Пары с историей бесплодия могут быть в состоянии определить этиологию, и, следовательно, выбрать соответствующее лечение.
- Парам из группы риска для наследования потомством болезни с угрозой для жизни, болезни с поздним началом (болезнь Хантингтона), предпочтительно планировать, выбрать соответствующие методы лечения, или ускорить процесс диагностики (например, ранней диагностики рака молочной железы)
- Пары, желающие потомство для производства HLA-совпадающих стволовых клеток, для страдающего ребенка со смертельным заболеванием.
Используемые методы
Для анализа на наличие генетических дефектов эмбриона, из него необходимо удалить либо первое полярное тельце из неоплодотворенной яйцеклетки и/или 1 или 2 клетки от каждого эмбриона. Это называется биопсией яйцеклетки или эмбриона и обычно делается перед тем, как происходит оплодотворение, или через 3 дня после оплодотворения. Биопсия на 6-10 клеточной стадии не оказывает отрицательного влияния на преимплантационное развитие. На этом этапе каждая клетка имеет полный набор хромосом. Обычно из эмбриона удаляется только одна клетка, так как ожидается, что будут одинаковыми со всеми другими клетками в эмбрионе. Иногда необходимо удалить вторую клетку из эмбриона, например, если сигнал в первой не обнаружен. Для диагноза предрасположенности с помощью первого и второго полярных телец, как показателей генетического статуса яйцеклетки, используется анализ методом FISH. Недостатком анализа полярных телец заключается в том, что он не принимает во внимание отцовские анеуплоидии.
Анализ биопсированной клетки использует один из двух методов:
- Флуоресцентная гибридизация in situ (FISH): биопсированная клетка фиксируется на предметном стекле, нагревается и охлаждается, и ее ДНК “помечается” цветными флуоресцентными красителями, называемыми зондами (маленькие кусочки ДНК, которые соответствуют исследуемым хромосомам), по одному для каждой определяемой хромосомы. В настоящее время может быть идентифицировано 8 из 23 хромосом. После завершения эмбриолог учитывает цвета под мощным микроскопом и в состоянии, в большинстве случаев, отличить нормальные от аномальных клеток. Этот процесс занимает около суток. Нормальные эмбрионы будут либо перенесены в матку на 4-й день после поиска яйцеклеток, или подвергнутся продленному культивированию и будут перенесены на 5-й день, как бластоцисты. Клетки, использовавшиеся для ПГД, больше не жизнеспособны, и не будут возвращены в эмбрион, но могут быть сохранены для будущих исследований.
- Полимеразная цепная реакция (ПЦР): методика, которая увеличивает количество копий специфичных регионов ДНК, чтобы произвести достаточное для анализа количество ДНК. ДНК является двухцепочечной (за исключением некоторых вирусов), и две цепи соединяются очень специфическим образом. “Последовательность кирпичиков” генов представляет собой определенный порядок появления 4-х различных дезоксирибонуклеотидов в сегменте ДНК. Эти 4 компонента: аденин (А), тимидин (T), цитозин (C), и гуанин (G). Последовательность этого 4-буквенного алфавита генерирует состав гена. При этой методике ДНК нагревают (денатурируют), чтобы разделить 2 нити. Далее добавляются праймеры и ДНК охлаждается, с тем чтобы опять образовались двойные нити. Затем в циклы добавляют ферменты, которые могут “прочитать” последовательность гена, что приводит к умножению ДНК. ПЦР используется для диагностики ген-специфических заболеваний, так же как и для выявления болезнетворных вирусов и/или бактерий, или в криминалистике в связи с подозрением в совершении преступления.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Предымплантационное генетическое тестирование при ЭКО

Количество женщин, пользующихся услугами центров репродуктивных технологий, за последние двадцать лет значительно возросло. Это объясняется тем, что семейные пары начинают планирование беременности в более позднем возрасте. Также расширен список диагнозов, при которых в прошлом беременность была невозможна, а сейчас многие пары могут иметь детей. В этих случаях, как правило, им на помощь приходит экстракорпоральное оплодотворение (ЭКО).
Факторы, влияющие на успех ЭКО
Казалось бы, что с увеличением количества ЭКО должен значительно вырасти уровень успеха этой процедуры. Однако, как показывают результаты многочисленных исследований на эту тему, несмотря на популярность ЭКО, улучшение диагностики бесплодия до этой процедуры, лучшее оснащение, лучший подбор лекарственных препаратов и разнообразие протоколов, процент успешных клинических беременностей изменился незначительно и продолжает оставаться в пределах 27–35 % случаев рождения живых детей уже многие годы. Оказалось, что успех процедуры мало зависит от тщательной подготовки эндометрия, техники переноса эмбрионов и поддерживающей гормональной терапии, а непосредственно связан только с качеством эмбрионов. А качество эмбрионов, в свою очередь, зависит от возрастного фактора.
Но так как далеко не все семейные пары способны иметь детей в более молодом возрасте, все чаще поднимается вопрос о том, как можно определить качество эмбрионов, особенно наличие отклонений в их хромосомном наборе. Также вопрос качества эмбрионов в отношении наличия определенных генов поднимаю те пары, у которых имеется семейная история заболеваний, связанных с наследственностью, то есть для них особенно важна хромосомно-генетическая характеристика — наличие генов или дефектов генов, причастных к возникновению серьезных заболеваний и пороков развития.
До сих пор во многих лечебных учреждениях отдают предпочтение традиционной инвазивной процедуре — забору ворсин хориона для изучения набора хромосом будущего ребенка (кариотипа), который обычно проводится на ранних сроках беременности. Если в кариотипе находят отклонения или измененные гены, женщине могут предложить прервать беременность. Но каково при этом бывает разочарование пар, которые потратили большие суммы на проведение ЭКО, получили желанный результат и столкнулись с дилеммой сохранения заведомо проблемной беременности или ее прерывания из-за дефекта хромосом и генов!
В большинстве публикаций, посвященных теме репродуктивных технологий, фигурируют данные о большей частоте пороков развития у плодов и новорожденных после ЭКО по сравнению с общей популяцией. Однако недавно появились данные, что предымплантационное генетическое тестирование не только понижает количество беременностей с плодами, пораженными пороками развития, хромосомными и генетическими заболеваниями, но и повышает уровень успешного проведения ЭКО и рождения здоровых детей. Объясняются эти утешительные сведения тем, что такое тестирование может отсеять дефектные эмбрионы еще до проведения ЭКО. Фактически проводится селекция здоровых эмбрионов, использование которых повысит шансы на получение здорового потомства.
Вокруг предымплантационного генетического тестирования в недавнем прошлом разгоралось много дискуссий, особенно в плане безопасности этой процедуры для самого эмбриона. Поскольку этот вид тестирования недешевый и требует как сложного технического оснащения, так и специалистов для его проведения и интерпретации, стоимость ЭКО в целом повышается. А значит, повышается и частота злоупотребления этим тестированием.
Виды предымплантационного тестирования
В современной репродуктивной медицине имеются две разновидности предымплантационного тестирования: предымплантационный генетический скрининг (ПГС) и предымплантационная генетическая диагностика (ПГД). В реальности четких отличий между двумя видами тестирования не существуют, так как они проводятся практически одними и теми же методами, но цели их проведения все же отличаются.
При ПГС проводят выявление (случайное) аномального хромосомного набора у эмбрионов, готовых к подсадке, и чаще всего этим видом тестирования пользуются в тех случаях, когда важную роль играет возрастной фактор. От 40 до 60 % всех эмбрионов вообще — некачественные, а с возрастом количество бракованных эмбрионов возрастает, к 40 годам достигая 80 %, что понижает уровень успешной имплантации после ЭКО до 6 %. Поэтому все чаще предимплантационный генетический скрининг используют у пар старше 35–37 лет, хотя четких рекомендаций, с какого возраста проводить ПГС, пока не существует.
В отличие от диагностики, скрининг может быть поверхностным, то есть с его помощью выясняют общее количество хромосом и отсутствие грубых «поломок» в них.
ПГД позволяет определить наличие пораженных генов или изменения в хромосомах при наличии в роду или семье генетических и хромосомных заболеваний. Существует около 200 заболеваний, связанных с поломкой всего лишь одного гена (кистозный фиброз, бета-талассемия, миотоническая дистрофия, синдром Марфана, мышечная дистрофия Дюшенна, гемофилия А и др.), включая возникновение наследственных видов рака (ретинобластома, рак молочной железы и др.).
Также подобная диагностика важна для определения пола будущего ребенка, поскольку ряд наследственных заболеваний может передаваться исключительно через половые хромосомы.
Технология проведения тестирования
Существует несколько технологий определения кариотипа и ДНК, в том числе полученной всего из одной клетки. Все технологии имеют свои преимущества и недостатки, поэтому результаты могут быть и ложно-положительными, и ложно-отрицательными, что требует от врача учета многих других важных фактов из истории семейной пары для принятия правильного решения.
Материал для исследования путем биопсии может быть получен из оплодотворенной яйцеклетки (через 8–14 часов после ее оплодотворения), и обычно такое тестирование проводится в странах, где получение клеток эмбриона запрещено. Этот сложный метод тестирования также имеет много погрешностей.
После оплодотворения яйцеклетка начинает делиться без увеличения ее размеров, что приводит к возникновению бластомера: сначала 2 клетки, дальше — 4, 8 и 16 клеток. При проведении биопсии используют обычно 1 клетку на стадии 8-клеточного (3-дневного) эмбриона. В прошлом для тестирования брали две клетки, но оказалось, что забор ¼ (25 %) клеточного состава будущего ребенка часто негативно отражался на развитии эмбриона. Также наблюдалась потеря других клеток (до 33 % клеточного состава эмбриона). На получение результатов уходит от 1 до 2 дней, поэтому подсадку проводят чаще всего на 5–6 день развития эмбриона. Такой вид биопсии сопровождается худшим уровнем имплантации эмбрионов — она снижается до 39 %.
Деление бластомера продолжается и начинают формироваться определенные части плодного яйца — так возникает морула, а за ней бластоцист, который содержит внутри уже небольшое количество жидкости, что позволяет провести забор от 5 до 10 клеток эмбриона. Большее количество клеток для исследования повышает качество диагностики, поэтому таким видом предымплантационного генетического тестирования сейчас стали пользоваться чаще.
Как показывают клинические исследования, ПГС и ПГД с использованием бластоциста не отражаются негативно на развитии эмбриона, одновременно улучшая качество и успех ЭКО, хотя при этом виде тестирования увеличивается количество женщин, которым ЭКО не проводят. Если не удается получить качественные и генетически здоровые эмбрионы, семейной паре могут предложить донорские яйцеклетки, или сперматозоиды, или готовые эмбрионы.
К сожалению, далеко не все репродуктивные клиники проводят предымплантационное генетическое тестирование. Качество эмбрионов в них определяется визуально — с учетом внешнего вида (морфологии) эмбрионов. Использование же предымплантационного генетического тестирования повышает успешность имплантации почти полтора раза по сравнению с визуальной оценкой.
Перед проведением любого вида предымплантационного генетического тестирования семейная пара должна быть ознакомлена с плюсами и минусами и этой процедуры, и самого ЭКО.
Конечно же, идеальным было бы тестирование, которое позволяло определить не только количество и вид хромосом, изменения в единичных генах, но и весь генетический профиль будущего ребенка (у человека имеется 20 000–25 000 генов, отвечающих за выработку белков, значение других участков ДНК пока не известно). Современные технологии, в том числе компьютерные, позволяют создавать карту генома человека (karyomapping), но этот процесс очень дорогостоящий, поэтому находится пока что на уровне эксперимента. Объемное тестирование требует и больше времени для получения результатов. Поэтому даже в репродуктивных клиниках ПГС и ПГД из-за дороговизны и нехватки времени проводят в сокращенном варианте (кариотип и/или генотирование для 10–12 распространенных заболеваний).
Тем не менее репродуктивную медицину уже невозможно представить без предымплантационного генетического тестирования, а быстрое совершенствование технологий позволяет заметно повышать качество и безопасность этой процедуры, давая возможность многим семейным парам иметь желаемое здоровое потомство.
Преимплантационный генетический анализ эмбрионов

Исследование проводится в рамках применения программы вспомогательной репродукции у пар, которые имеют высокий риск передачи генетических патологий или появления хромосомных нарушений у потомства. В результате в полость матки переносятся только эмбрионы, не имеющие аномалий в генетическом статусе.
ПГД – это реально работающий метод , позволяющий снизить риски спонтанных абортов и способствующий уменьшению неудачных попыток ЭКО.
История преимплантационной генетической диагностики (ПГД)
В норме генетический материал человека закодирован в 44 аутосомных хромосомах. Полный хромосомный набор представлен 22 соматическими парами и одной половой парой (у мальчиков ХУ, а у девочек ХХ). Однако нередки ситуации, когда количество хромосом может уменьшиться или, наоборот, увеличиться в результате сбоя в процессе деления клеток. Это приводит либо к рождению детей с хромосомными синдромами и множественными пороками развития, либо к подсадке нежизнеспособного эмбриона (такая беременность прерывается в первом триместре), либо к отсутствию имплантации. Чтобы снизить подобные неудачи ЭКО до этапа переноса эмбриона в маточную полость, было предложено проводить преимплантационную генетическую диагностику. Чуть позже выяснилось, что с помощью такой технологии можно также избежать передачи моногенного заболевания, носителем которого может оказаться один из родителей. Подсаживаться будут только те эмбрионы, в структуре которых нет этого аллеля.
Интересно отметить, что идея проведения подобного исследования зародилась еще до эры вспомогательных репродуктивных технологий у человека. Произошло это в 1967 году, когда ученые провели забор материала кроличьих эмбрионов, чтобы определить пол еще до подсадки. В репродуктивной медицине человека проведение генетического тестирования стало возможно с 90-х годов XX столетия, и связано с более широким распространением ЭКО и изобретением метода полимеразной цепной реакции.
Сначала в 1989 году перед имплантацией определили пол будущего ребенка. Для родителей это было важно, т.к. Х-хромосома одного из супругов содержала дефектный ген, и риск рождения больного ребенка был высок. В 1990 году уже удалось идентифицировать эмбрионы с моногенными нарушениями, в частности это касалось муковисцидоза. Позже ПГД шагнула еще дальше, предоставив возможность лечить больного брата или сестру с помощью пересадки костного мозга, свободного от мутации и полностью совместимого по системе HLA.
Как передаются по наследству генетические заболевания
Генетические заболевания, в отличие от хромосомных, связаны с изменением структуры генетического кода, когда один или несколько его участков являются патологическими. Подобные нарушения могут затрагивать как соматические хромосомы, так и половые. Стоит отметить, что мутантный аллель может быть доминирующим, то есть его влияние в паре всегда превалирует, или рецессивным, то есть патологический признак не проявится, если будет здоровый доминант. Этим определяются типы наследования генетических заболеваний. Хромосомный набор в норме всегда парный. Поэтому возможны следующие варианты:
- пара определенного генетического не имеет никаких мутаций – ребенок здоров;
- пара содержит один мутантный аллель, но он рецессивный, а доминантный аллель здоровый – заболевания нет, но ребенок является носителем патологии (может передавать ее потомству);
- пара содержит 2 мутантных аллеля и оба рецессивные – заболевание проявится;
- пара содержит 1 мутантный аллель доминантного типа – заболевание проявится, даже если рецессивный аллель здоровый;
- пара содержит 2 мутантных аллеля доминантного типа – генетическая патология проявится.
Наследственные заболевания связаны со структурными изменениями наследственной информации клеток человека. Вероятность передачи «поломки» зависит от конкретного типа патологии, т.к. разные виды по-разному наследуются.
Типы наследования могут быть следующими:
- аутосомно-доминантные;
- аутосомно-рецессивные;
- Х-сцепленные доминантные;
- Х-сцепленные рецессивные;
- У-сцепленные (голандрические) – на У-хромосоме в целом мало генов, поэтому такие заболевания редкие и практически не передаются потомству, т.к. в большинстве случаев такие мужчины стерильны (гены У-хромосомы отвечают за сперматогенез и развитие яичек);
- митохондриальные – наследуются только по материнской линии (если мать больна, то будут больны все дети). Для выявления митохондриальных болезней обследование должна пройти женщина до зачатия с помощью секвенирования митохондриальной ДНК. Это выходит за рамки ПГД.
Отнесение болезни к той или иной группе позволяет генетику предположить, с какой вероятностью она проявится у потомства и составить оптимальный репродуктивный план для пары.
Доминантные заболевания
В случае доминантного наследования патологический признак превалирует над здоровым. Поэтому при его наличии (хоть в одной, хоть в 2 хромосомах) ребенок всегда болен. Здоровые дети не являются носителями мутантного аллеля.
По аутосомно-доминантному типу наследуются болезнь Марфана (поражение соединительной ткани), боковой амиотрофический склероз (поражение структур спинного мозга), нейрофиброматоз (из нервной ткани образуются опухоли), семейная гиперхолестеринемия и др.
Рецессивные заболевания
При рецессивном типе наследования заболевание проявляется только в том случае, если патологический участок присутствует одновременно в 2 хромосомах из пары. Здоровые дети от больных родителей могут быть как носителями патологического гена (одна из хромосом имеет повреждение), так и не иметь его в своем наборе (2 хромосомы в паре абсолютно нормальны).
Рецессивный тип передачи наследственного заболевания часто встречается при близкородственных браках. Основными представителями этой группы являются анемия Фанкони, лизосомные болезни накопления, фенилкетонурия, синдром Жильбера, наследственная тугоухость и другие.
Для генетики справедливо правило – если у двух здоровых родителей ребенок болен, то такой тип наследования считается рецессивным.
Х-сцепленные заболевания
Чаще всего в популяции встречаются Х-сцепленные заболевания, намного реже – У-сцепленные. В последнем случае патологический признак выявляется только у мужчин и передается по мужской линии всем сыновьям.
Х-сцепленное наследование может быть доминантным и рецессивным.
- В случае доминантного Х-сцепленного наследования от матери пораженная Х-хромосома передается как сыновьям, так и дочерям. Отцы с мутантной Х-хромосомой передают ее только дочерям (сыновья здоровы, т.к. нормальную Х-хромосому наследуют от матери). По таком механизму передается пигментный дерматоз, гипоплазия зубной эмали, устойчивый к витамину Д рахит.
- Х-сцепленное рецессивное наследование приводит к тому, что у сына проявляется заболевание. Если же передается дочери больная Х-хромосома, то ребенок, как правило, здоров (болезнь развивается только, если и вторая хромосома от отца тоже повреждена). По такому типу передаются гемофилия, глазной альбинизм, куриная слепота, дальтонизм, миодистрофия Дюшена.
Возможные преимущества генетического анализа
Что значит ПГД эмбриона? Это высокотехнологичное исследование помогает решать сразу несколько важных задач, связанных с улучшением репродуктивных и медико-генетических исходов беременности. Благодаря генетическому анализу, удается достигать следующих целей:
- уменьшать число неэффективных переносов;
- уменьшать вероятность спонтанного прерывания беременности;
- повышать шансы успешной беременности у женщин из групп повышенного генетического риска;
- предотвращать передачу по наследству генетически обусловленных заболеваний;
- уменьшить риск хромосомной патологии у новорожденных;
- снизить риск резус-конфликта.
В результате проведения ПГД снижается риск рождения больного ребенка, риск невынашивания и многоплодия, увеличиваются шансы на успешную имплантацию (в среднем на 10%) и на благополучное рождение ребенка (примерно на 15-20%).
Что дает ПГД эмбриона еще? Если брат или сестра от одних родителей имеют заболевание, связанное с мутацией, требующее пересадки костного мозга, и в базе данных подобрать совместимого донора не удается, то на помощь приходит ЭКО с преимплантационным скринингом. Что показывает ПГД в этом случае? Благодаря этому исследованию удается подобрать эмбрион, который не только не содержит мутации, но и полностью совместим по тканевым антигенам. Такое направление в терапии применяется в США и Европе уже более 15 лет, а в России с 2016 года, когда девочке с синдромом Шахванда-Даймонда пересадили здоровые стволовые клетки от ее родного брата, зачатого путем ЭКО.
Показания к преимплантационной генетической диагностике
Метод ПГД в первую очередь предназначен для выявления количественных нарушений в хромосомном наборе эмбриона, которые не являются летальными, но могут приводить к рождению ребенка с пороками развития. Это касается 13,18, 21-й пары аутосом и половых хромосом – Х- и У.
Стоит отметить, что риск генетических нарушений у плода возрастает с увеличением возраста матери. Так, Всемирная организация здравоохранения приводит такие данные статистики. Вероятность рождения ребенка с трисомией (состояние, когда вместо 2 одинаковых хромосом, имеется 3) у женщины в возрасте до 30 лет составляет 1 случай на 385 беременностей, в возрасте 40 лет – 1 случай на 63 беременности и возрасте 45+ – 1 случай на 19 беременностей. А женщины, которые вступают в программу ЭКО, зачастую перешагнули рубеж в 35-40 лет.
К тому же, некоторые хромосомные аномалии являются летальными, то есть несовместимыми с жизнью. Клинически это проявляется самопроизвольными выкидышами на ранних сроках беременности. Частота их по причине хромосомных аномалий в первом триместре доходит до 60%. Поэтому чтобы вам подсадили наиболее качественный эмбрион (без генетических поломок), и проводится ПГД.
Что показывает ПГД эмбриона еще? Это исследование позволяет также идентифицировать носительство конкретных мутантных аллелей и выбрать для подсадки здоровые эмбрионы, которые лишены патологического гена.
Таким образом, ПГД работает и в отношении выявления хромосомных синдромов, и в отношении генетических заболеваний.
Кому показано ПГД
Европейское общество репродуктологов и эмбриологов рекомендует проводить преимплантационный тест при наличии следующих показаний:
- у пары в анамнезе 1 или несколько беременностей, которые самостоятельно прервались;
- 2 и более попытки искусственного оплодотворения, которые закончились неудачей;
- возрастная категория женщины 35+;
- наличие подтвержденного мужского фактора бесплодия;
- наличие беременностей с объективно подтвержденной хромосомной патологией плода;
- мужчина и/или женщина из пары – носители структурных хромосомных перестроек (выявлено с помощью соответствующего генетического анализа).
Помимо этого ПГД эмбриона при ЭКО рекомендуется женщинам со сниженным овариальным резервом. Уменьшение численности фолликулов в яичниках практически всегда ассоциировано с плохим качеством яйцеклеток, в которых увеличивается риск спонтанных мутаций. Поэтому чтобы подсадить в полость матки здоровый эмбрион, проводится преимплантационный скрининг. Это же исследование показано также парам, у которых в анамнезе были случаи пузырного заноса, неразвивающейся и биохимической (уровень ХГЧ был повышен, но дальше гестационный процесс прервался на очень раннем сроке) беременности.
Состояния, диагностируемые с помощью ПГД
Анализ ПГД эмбриона – что это? Данное исследование позволяет провести генетическое изучение эмбрионов на нулевые сутки, 3-и или 5-ые. С помощью этого теста выявляют различные хромосомные аномалии еще до подсадки эмбриона в полость матки для того, чтобы предотвратить рождение ребенка с генетическими отклонениями и наследственными заболеваниями.
ПГД эмбриона позволяет объективно диагностировать носительство конкретных генетических патологий. В свою очередь преимплантационный генетический скрининг в медицине репродукции направлен на выявление общих изменений количества хромосом (увеличение или уменьшение).
Условно все нарушения в строении генетического аппарата будущего ребенка можно разделить на 3 категории:
- хромосомные изменения;
- генетические мутации, которые затрагивают один или несколько генов;
- спонтанное возникновение мутаций в половых клетках (родители здоровы, а проблема появляется впервые у ребенка).
Заболевания, сцепленные с полом
Практически все заболевания, которые сцеплены с полом, наследуются через патологически измененную Х-хромосому. Поэтому женщины могут быть как больными, так и здоровыми носителями. Мужчины всегда проявляют заболевание. Патологии, сцепленные с полом, возникают при наличии мутаций в половых хромосомах родительских организмов и связаны с нарушением генетических процессов.
Наиболее распространенными патологиями этой группы являются:
- гемофилия;
- дальтонизм;
- фосфат-диабет;
- мышечная дистрофия Дюшена, Леша-Найхана и другие.
Одиночные дефекты гена
Одиночные дефекты гена могут приводить к развитию моногенных заболеваний у потомства. Благодаря ПГД удается подсадить эмбрион, который не имеет соответствующей мутации. Так наследуются:
- муковисцидоз – заболевание, при котором образуется густой секрет, приводящий к закупорке выводных протоков желез (чаще поражаются легкие, бронхи, поджелудочная железа);
- несиндромальная нейросенсорная тугоухость – снижение слуха вследствие повреждения нервных рецепторов внутреннего уха;
- наследственные миопатии – слабость мышц, связанная с нарушением их развития или нарушением иннервации, приводящая к обездвиженности.
Хромосомные расстройства
Хромосомные заболевания не зависят от генетического аппарата родителей, а возникают при нарушениях расхождения хромосом в процессе мейотического деления.
Наиболее частые хромосомные заболевания, связанные с изменением численности хромосом, это:
- синдром Эдвардса – есть лишняя хромосома в 18-й паре;
- синдром Патау – дополнительная хромосома в 13-й паре;
- синдром Дауна – третья хромосома в 21-й паре;
- синдром «кошачьих зрачков» – дополнительная копия определенного участка на 22-й хромосоме .
Кандидаты для биопсии эмбриона и ПГД
Биопсия эмбриона и преимплантационное генетическое тестирование проводится в тех ситуациях, когда риск хромосомных и генных нарушений достаточно высок. В первую очередь это определяется возрастом родителей. Задуматься о возможных генетических поломках стоит женщинам старше 35 лет и мужчинам старше 40 лет. Помимо этого есть определенные клинические ситуации, когда повышена вероятность генетических нарушений. Последние могут быть причиной привычного невынашивания беременности, многократных неудачных попыток ЭКО. ПГД рекомендуется и в тех случаях, когда имеется мужское бесплодие, связанное с хромосомными аномалиями, или же кто-то из потенциальных родителей имеет доказанное носительство хромосомных перестроек, транслокаций, инверсий и других хромосомных патологий.
Пары с повторными неудачами ЭКО
Повторные неудачи ЭКО нередко связаны с наличием генетических аномалий у эмбриона/плода. Преимплантационная диагностика позволяет отбирать только здоровые эмбрионы. Это в разы повышает результативность цикла ЭКО, снижает вероятность рождения ребенка с хромосомными аномалиями, а также риск спонтанных прерываний беременности.
Используемые методы
Как делают ПГД эмбриона? Состояние будущего плода изучают в самые ранние сроки его развития. Материалом для исследования могут служить полярные тельца, бластомеры и клетки трофэктодермы. Оптимальным вариантом является исследование трофэктодермы, т.к. это самый малотравматичный вариант биопсии, а биопсийный материал, который получают на 5-е сутки, наиболее информативен. Генетику удается получить большее количество эмбриональных клеток, а значит, и большее количество копий ДНК. В рамках тестах изучается последовательность нуклеиновых кислот.
Раньше изучались единичные хромосомы. Как правило, те, в которых чаще всего встречаются проблемы. На сегодня микроматричная сравнительная геномная гибридизация позволяет исследовать все пары хромосом (как соматические, так и половые).
Репродуктивный центр «СМ-Клиника» располагает необходимым оборудованием и квалифицированными специалистами для проведения ПГД в соответствии с рекомендациями международного общества репродуктологов.


